|
Forscher
>
Prof. Dr. med. Michael Bauer
>
Blutdrucksenkende Wirkung von Omega-3-Fettsäuren
Blutdrucksenkende Wirkung von Omega-3-FettsäurenGesundes Fett im FischAufgrund unterschiedlicher gesundheitsfördernder Effekte sind Omega-3-Fettsäuren buchstäblich in aller Munde, aber nur langsam lichten sich die Schleier bezüglich der zu Grunde liegenden molekularen Wirkmechanismen. Es wird zunehmend klar, dass man sehr kritisch prüfen muss, um welche Fettsäuren es sich tatsächlich handelt. Omega-3-Fettsäuren Langkettige Omega-3-Fettsäuren wie die Docosahexaensäure (DHA) kommen in fettigem Fisch wie Hering, Lachs, Sardelle oder Makrele vor und gelten als ein wichtiger Bestandteil einer gesunden Ernährung. Ihre Aufnahme wird u.a. mit einer blutdrucksenkenden Wirkung, einer Stärkung des Immunsystems sowie positiven Effekten auf die Entwicklung des Nervensystems und auf das Herz-Kreislauf-System assoziiert. Klinische Studien zur Einnahme von Nahrungsergänzungsstoffen mit Omega-3-Fettsäuren zeichnen allerdings kein klares Bild. Ein Grund für die Heterogenität solcher Untersuchungen liegt sicherlich darin, dass in vielen Fällen unterschiedliche, mehrfach ungesättigte Fettsäuren als „Omega-3-Fettsäuren“ zusammengefasst werden (s. Infobox), was eine objektive Vergleichbarkeit erschwert. Streng genommen müsste eine Ernährung mit pflanzlichen ω-3-Fettsäuren wie der α-Linolensäure ausreichend sein, da diese im Körper zu Eicosapentaensäure (EPA) und DHA umgebaut werden können. Die vermehrte Aufnahme von DHA und EPA scheint jedoch einen zusätzlichen positiven Effekt auf die Gesundheit auszuüben. Dementsprechend gilt landläufig die Devise „Fisch ist gesund“. Als Folge dessen erfreuen sich zahlreiche Nahrungsergänzungsmittel, die Fischöle oder synthetische ω-3-Fettsäuren enthalten, einer großen Beliebtheit. Hier lohnt sich ein genauer Blick auf den Beipackzettel, denn solche Produkte enthalten oft auch leicht modifizierte Varianten wie z.B. Fettsäuren, die an der Carboxygruppe einen Ethylester aufweisen (DHA-EE und EPA-EE; s. Infobox). Die vielfältigen Beobachtungen bezüglich gesundheitsfördernder Effekte von DHA und EPA waren für lange Zeit mit einem unzureichenden Verständnis der molekularen Wirkmechanismen gepaart. In diesem Jahr gab es jedoch auf diesem Gebiet erfreuliche Fortschritte. Eine amerikanische Studie konnte zeigen, dass DHA in Makrophagen zu so genannten Maresinen (Maresin = macrophage-derived mediators of inflammation resolution) umgesetzt werden kann. Maresine wiederum unterdrücken Entzündungsreaktionen und terminieren die Immunantwort [1]. Dies könnte eine Erklärung für die positive Wirkung von DHA bei chronischen Entzündungen wie Arthritis, Rheuma oder Atherosklerose darstellen. Für diesen Signalweg ist DHA nur eine Vorstufe, während eine direkte Bindung von DHA an ein Rezeptorprotein durch Oh et al. [2] gezeigt wurde. Offenbar wird der G-Protein-gekoppelte Rezeptor 120 (GPR120), der in die Entzündungsreaktion und die Gewichtskontrolle involviert ist, direkt durch DHA aktiviert; dies geschieht allerdings erst bei einer relativ hohen effektiven Konzentration von ca. 10µM.
Abb.1 Modell eines BK-Kanals. Diese K+-selektiven Kanäle, bestehend aus 4 Slo1 Proteinuntereinheiten, werden sowohl durch elektrische Depolarisation der Membran als auch durch einen Anstieg in der intrazellulären Ca2+-Konzentration geöffnet. Der dann einsetzende Auswärtsstrom von K+ bewirkt eine Hyperpolarisation und führt in glatten Muskelzellen zur Relaxation. Bei glatten Muskelzellen der Blutgefäße hat dies eine Weitung der Gefäßwand und eine Senkung des Blutdrucks zur Folge. Offenbar sind BK-Kanäle hoch-affine Rezeptoren für die Omega-3-Fettsäure DHA. Grün: Membranständiger Proteinteil, basierend auf einer Homologiemodellierung zu Kv1.2/Kv2.1 (PDB 2R9R); blau: regulative zytosolische Domäne entsprechend der Röntgenstruktur PDB 3NAF. In den markierten Bereichen (rot/magenta) befinden sich Bindestellen für Ca2+-Ionen. Der Verbindungsbereich zwischen der Transmembrandomäne und der zytosolischen Domäne ist noch nicht strukturell aufgeklärt und fehlt daher in dieser Darstellung.
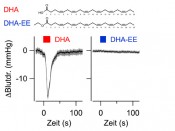
Kaliumkanäle als Rezeptoren für DHA In einer interdisziplinären Zusammenarbeit mit Prof. T. Hoshi von der University of Pennsylvania, Philadelphia konnten wir nun eine direkte Einflussnahme von DHA auf den vaskulären Tonus und somit auf den Blutdruck nachweisen [3]. Die „Rezeptoren“ für DHA sind dabei sogenannte BK-Kaliumkanäle (synonym zu MaxiK- oder BKCa-Kanälen). Diese Kanalkomplexe aus vier Slo1 ω-Untereinheiten (s. Abb.1) werden sowohl durch einen Abfall der elektrischen Membranspannung als auch durch einen Anstieg in der intrazellulären Ca2+-Konzentration aktiviert. Einmal geöffnet, leiten diese Kanäle einen sehr großen K+-Strom (daher „BK“ = big conductance K+), was die Membranspannung wieder erhöht. In erregbaren Zellen, wie z.B. glatten Muskelzellen oder Neuronen, wirkt der BK-Kanal somit als negativer Rückkoppler, indem er einer verstärkten zellulären Erregung – einhergehend mit geringem Membranpotenzial und hohem Ca2+-Spiegel – entgegenwirkt. In glatten Muskelzellen, die Blutgefäße umschließen, bewirkt die Aktivierung von BK-Kanälen eine Relaxation und als Folge dessen eine Gefäßerweiterung und einen Abfall des Blutdrucks. DHA bindet an den BK-Kanalkomplex mit hoher Affinität (ca. 500nM) und bewirkt ein Öffnen des Kanals. Mechanistisch geschieht dies durch eine Verschiebung der Spannungsabhängigkeit des Kanals, sodass dieser nun in der Gegenwart von DHA schon beim Ruhemembranpotenzial aktiviert wird und einer zellulären Erregung entgegenwirkt. Dieser Effekt ist erheblich geringer bei der etwas kürzeren EPA und noch viel kleiner bei der in Pflanzen vorkommenden α-Linolensäure (ALA). BK-Kanäle scheinen also besonders gut durch ω-3-Fettsäuren mit einer Kettenlänge von 22 C-Atomen aktiviert zu werden. Allerdings gilt dies nicht für die endständig modifizierten Ethylester: DHA-EE aktiviert BK-Kanäle nicht. Mehr noch, in Mischungen mit DHA reduziert es sogar die aktivierende Wirkung von DHA. Ebenso vermag oxidiertes DHA (17-OH DHA) den Kanal nicht zu öffnen. BK-Kanäle sind also offenbar sehr spezifische Rezeptoren für Docosahexaensäure. Aus diesen molekularen Untersuchungen ließ sich schließen, dass DHA vermutlich einen über BK-Kanäle vermittelten Einfluss auf den Blutdruck hat. Dies konnte in weiteren Experimenten mit narkotisierten Mäusen eindrücklich nachgewiesen werden. Wie in Abbildung 2 dargestellt, führte eine intravenöse Injektion von DHA zu einem akuten Blutdruckabfall. Solch eine Reaktion blieb völlig aus bei Knock-out-Mäusen, in denen das Slo1-Gen inaktiviert wurde und somit keine BK-Kanäle gebildet werden. Darüber hinaus hatte DHA-EE, die Ethylester-Verbindung von DHA, die sich häufig in Omega-3-Fettsäure-Pillen befindet, keinen Einfluss auf den Blutdruck (Abb.2). Den Blutdruck betreffend kann die Gabe von nicht natürlichen Omega-3-Fettsäuren folglich sogar kontraproduktiv sein, wenngleich natürlich bei der Aufnahme über die Nahrung noch ein komplexer Metabolismus, der über Esterasen zu einer mehr oder weniger vollständigen Freisetzung dieser Fettsäuren führen soll, berücksichtigt werden muss. Im Licht der widersprüchlichen Ergebnisse zu den kardiovaskulären Wirkungen der Omega-3-Fettsäure-Präparate [4] besteht hier jedoch sicher Bedarf an klinischer Forschung. Der Einfluss von DHA auf die Funktion von BK-Kanälen hängt zudem davon ab, aus welchen Proteinuntereinheiten der Kanalkomplex besteht. Neben vier identischen α-Untereinheiten (s. Abb.1) werden noch bis zu zwei Hilfsproteine (α-Untereinheiten) in den Komplex eingebaut. Die Wirkung von DHA ist besonders groß, wenn entweder Slo-β1 oder Slo-β4 vorliegen [5]. Da Slo-β1 hauptsächlich in glatten Muskelzellen und Slo-β4 in Neuronen vorkommt, ist zu erwarten, dass DHA neben der blutdrucksenkenden Wirkung über die Relaxation von glatten Muskelzellen auch einen dämpfenden Einfluss auf die neuronale Erregbarkeit ausüben kann.
Abb.2 Die Omega-3-Fettsäure DHA (Docosahexaensäure) und der entsprechende Ethylester (DHA-EE) unterscheiden sich markant in ihrer Wirkung auf den Blutdruck in anästhesierten Mäusen. Während eine Injektion von DHA zu einem starken Blutdruckabfall führt, ist DHA-EE weitgehend wirkungslos.
Ein schmaler Grad zwischen „gut“ und „schlecht“ Neben ihrem Einsatz als „Nutriceuticals“ in Nahrungsergänzungsmitteln für die Allgemeinbevölkerung werden Omega-3-Fettsäuren wegen ihrer vermuteten gesundheitsfördernden Eigenschaften – insbesondere der Hemmung von Entzündungsprozessen – auch gezielt Ernährungslösungen für kritisch kranke Intensivpatienten zugesetzt. In vergleichenden Studien waren die Ergebnisse dieser so genannten „Immunonutrition“ jedoch widersprüchlich. Während bei postoperativen Patienten insbesondere eine enterale Ernährung, die u.a. mit Omega-3-Fettsäuren angereichert wird, die Liegedauer auf der Intensivstation sowie die Infektionsrate reduziert, ist der Einsatz bei kritisch kranken, insbesondere septischen Patienten potenziell sogar gefährlich [6]. Bei diesen Patienten kommt es z.B. durch Induktion der Stickstoffmonoxidbildung regelhaft zu einem teils dramatischen Abfall des peripheren Gefäßwiderstands und damit des Blutdrucks. Die Verstärkung des Abfalls durch Aktivierung von BK-Kanälen, ausgelöst durch DHA, könnte dabei einen möglichen Faktor für die ungünstigen Effekte der Omega-3-Fettsäuren bei Patienten mit lebensbedrohlichen Infektionen darstellen. Es bleibt also genau zu untersuchen, unter welchen klinischen Bedingungen welche Omega-3-Fettsäuren förderlich sein können und wie diese genau zu dosieren sind. Letztlich bleibt die Erkenntnis, dass es sich bei diesen „natürlichen“ Produkten keineswegs um immer unbedenkliche oder gesunde Nahrungsmittelinhaltsstoffe handelt, wenn sie in hohen Konzentrationen unter bestimmten Bedingungen verabreicht werden. Vielmehr sollten sie als Pharmaka mit einem definierten Wirkmechanismus betrachtet werden. Durch die gezielte Erforschung der molekularen Wirkmechanismen wie z.B. der Identifizierung von BK-Kanälen als spezifische Rezeptoren für DHA [3] und der Aufklärung der indirekten Wirkung von DHA über die Bildung von Maresinen [1] sollte es aber in naher Zukunft gelingen, Studien zur Aufnahme von Omega-3-Fettsäuren und deren Effekte auf den Organismus besser interpretieren zu können.
Literatur Foto: © 123rf.com | Leonello Calvetti |
L&M 6 / 2013
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |