|
L&M-4-2012
>
Isotopenverdünnung in der quantitativen Ramanspektrometrie
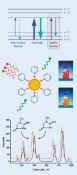
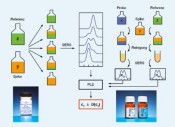
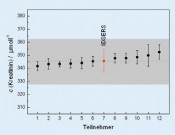
Isotopenverdünnung in der quantitativen RamanspektrometrieMolekulare FingerabdrückeDie Ramanspektrometrie hat sich in der chemischen Analytik und den Material wissenschaften inzwischen als unverzichtbares Werkzeug zur Charakterisierung und Identifizierung von Substanzen etabliert. Die Bestimmung von Stoffmengenkonzentrationen galt dagegen lange Zeit als zu ungenau. Erst durch Kombination aus oberflächenverstärkter Ramanstreuung und dem Konzept der Isotopenverdünnung wurde die Basis für ein empfindliches und hochgenaues Mess verfahren für die Metrologie in der Chemie geschaffen, dessen Resultate in internationalen Vergleichen bestätigt wurden. Weltweit besteht ein zunehmender Bedarf an zuverlässigen chemisch-analytischen Messungen. Ihre Ergebnisse berühren oft Leib und Leben jedes einzelnen Menschen, sei es in der medizinischen Diagnostik oder bei der Überwachung von Grenzwerten in der Lebensmittel- und Umweltanalytik. Aufgabe des Fachbereichs Metrologie in der Chemie der Physikalisch-Technischen Bundesanstalt (PTB) ist es, die Konzepte der Metrologie – der Wissenschaft und Anwendung des Messens – auf die chemische Analytik zu übertragen und damit Handel und Gesellschaft einen international anerkannten metrologischen Bezugsrahmen für chemische Messgrößen bereitzustellen. Dies geschieht durch Entwicklung und Weitergabe nationaler Normale für die Stoffmenge und der Einheit „Mol“. Metrologie in der Chemie – chemische Analytik, rückgeführt auf nationale Normale Wesentlicher Bestandteil dieser Normale sind Messverfahren, mit denen eine Substanz eindeutig identifiziert und mit höchster Genauigkeit quantifiziert werden kann. Hierzu werden heute praktisch ausschließlich Verfahren eingesetzt, die auf der Massenspektrometrie (MS) basieren. Das geforderte Höchstmaß an Genauigkeit bei der Bestimmung einer Analytkonzentration wird dabei durch das Prinzip der Isotopenverdünnung (isotope dilution, ID) erreicht. Dazu wird der Originalprobe der Analyt in einer anderen als der natürlichen Isotopenzusammensetzung („Spike“) in bekannter Menge hinzugefügt. Aus dem massenspektrometrisch gemesse nen Häu fi gkeitsverhältnis der beiden sog. Isotopologe lässt sich die in der Probe enthaltene Analytkonzentration berechnen. Zwar lassen sich mit der IDMS äußerst geringe Substanzmengen detektieren und quantifizieren, direkte Informationen über die Molekülstruktur bleiben hingegen verborgen. Die Ramanspektrometrie hingegen bietet als Methode der optischen Spektrometrie Zugang zu diesen Informationen (Abb. 1, oben). Mit ihr werden charakteristische Eigenschwingungen eines Moleküls detektiert, deren Kombination – ähnlich wie die Hautlinien eines Menschen – einen unverwechselbaren „Fingerabdruck“ einer Substanz ergibt. Auf diese Weise ist selbst eine Unterscheidung verschiedener Strukturvarianten (Isomere) eines Analytmoleküls möglich und die Analyse der oft wertvollen Probe erfolgt in der Regel zerstörungsfrei. Aufgrund der Massensensitivität der Molekülschwingungen ist auch hier das Prinzip der Isotopenverdünnung anwendbar. Lange Zeit galt die Ramanspektrometrie als zu wenig empfindlich. Dies gilt besonders im Hinblick auf eine Reihe von Substanzen, die als sog. Biomarker in der medizinischen Diagnostik eine bedeutende Rolle spielen. Ihre physiologischen Konzentrationen in Blutserum, der natürlichen Umgebung, sind in der Regel zu gering für eine Detektion mittels konventioneller Ramanstreuung. Dieses Problem kann jedoch durch Anwendung der sog. Oberflächenverstärkten Ramanstreuung (surfaceenhanced Raman scattering, SERS) gelöst werden. Dieser 1974 von Fleichschmann [1] gefundene Effekt setzt voraus, dass das zu detektierende Analytmolekül zuvor an metallische (Gold, Silber) Nanopartikel oder nanostrukturierte Oberflächen adsorbiert wurde (Abb. 1, Mitte). Die eigentliche Raman-Signalverstärkung resultiert aus einer Anregung von Oberflächenplasmonen des Metalls durch eine geeignete (Laser-) Wellenlänge. Infolgedessen wirken starke lokale elektrische Felder auf die Moleküle in unmittelbarer Nähe der Metalloberfläche, was einen Anstieg der Ramanstreuintensität um mehrere Größenordnungen zur Folge hat [2]. Vorteilhaft ist außerdem, dass mit der Steigerung der Empfindlichkeit auch eine Unterdrückung der oftmals störenden Fluoreszenz einhergeht. Neu kombiniert – oberflächenverstärkte Ramanspektrometrie und Isotopenverdünnung Die Kombination aus oberflächenverstärkter Ramanstreuung und Isotopenverdünnung vereint somit eine hohe Nachweisempfindlichkeit mit einem Höchstmaß an Genauigkeit bei der Quantifizierung – eine ideale Kombination für die Metrologie in der Chemie? Dieser Frage wurde in den vergangenen Jahren an der PTB nachgegangen. Dabei wurden Verfahren entwickelt, mit denen sich die Konzentration von Biomarkern wie Kreatinin, Harnsäure oder Harnstoff in Blutserum hochgenau messen lässt [3–5]. Das als IDSERS bezeichnete Verfahren soll am Beispiel des Kreatinins, eines diagnostischen Markers zur Beurteilung der Nierenfunktion im Folgenden beschrieben werden. Als Spike dient hier ein synthetisches Kreatinin, in dessen Molekülgerüst an insgesamt 3 Positionen Kohlenstoff und Stickstoff durch ihre schwereren Isotope, 13C und 15N, ersetzt wurden (Abb. 1, unten). Dadurch vergrößert sich die molare Masse des Kreatinins von 113 auf 116 g mol-1, was zu einer Verringerung der Energie verschiedener Molekülschwingungen führt. Im Ramanspektrum des 2-13C 2,3-15N2 Kreatinins sind die entsprechenden Schwingungsbanden zu geringeren Wellenzahlen verschoben. Die wesentlichen Arbeitsschritte einer kompletten Serumanalyse lassen sich in einem Ablaufschema zusammenfassen (Abb. 2). Die eigentliche Probenmessung beginnt mit der Zugabe einer definierten Menge des Spikes zu einer ebenfalls genau bekannten Menge eines Humanserums. Erst dann wird der gesamte Prozess der Probenvorbereitung durchlaufen, wobei störende Substanzen abgetrennt werden. Auch wenn der Analyt hierbei nicht vollständig mitgenommen wird (Wiederfindung < 1), bleibt das Häufigkeitsverhältnis der beiden Kreatininisotopologe wegen ihres gleichen chemischen Verhaltens unverändert. Die Messunsicherheit wird somit nicht durch die Wiederfindungsrate beeinflusst und die Messung bleibt stets an die Ausgangsprobe gekoppelt und damit rückführbar. Zudem wird eine Bestimmung der nur unzureichend reproduzierbaren, absoluten Ramansignalintensitäten vermieden. In der Praxis werden die Probenaufbereitung und das anschließende IDSERS-Experiment nicht nur mit der Probe unbekannten Gehaltes durchgeführt, sondern auch mit einer Vergleichsprobe bekannter Analytstoffmenge. Bei diesem auch als „exact matching“ bezeichneten Verfahren werden Probe und Vergleichsprobe mit der gleichen Stoffmenge Spike versetzt [6]. Die Stoffmenge des Analyten in der Vergleichsprobe wird variiert mit dem Ziel, die Häufigkeitsverhältnisse der beiden Isotopologe in der Probe und der Vergleichsprobe aneinander anzugleichen. Auf diese Weise lässt sich die Messunsicherheit verringern, da sich das Ergebnis auf ein mit hoher Genauigkeit bekanntes Normal, die Vergleichsprobe, stützt. Die Häufigkeitsverhältnisse in Probe und Vergleichsprobe werden mit einem zuvor erstellten Vorhersagemodell bestimmt. Modellerstellung und -validierung durch multivariate Datenanalyse basieren auf einer Serie von SERS-Spektren, die aus definiert zusammengesetzten Mischungen von Spike und Kreatininreferenzmaterial erhalten wurden. Um den Einfluss systematische Beiträge zur Messunsicherheit z. B. durch Drift oder Trends zu verringern, werden die zur Modellerstellung und Probenanalyse erforderlichen Einzelmessungen miteinander in zufälliger Reihenfolge kombiniert. Mit dem erstellten Modell werden dann die Häufigkeitsverhältnisse in Probe (Rbx) und Vergleichsprobe (Rbz) vorhergesagt, und daraus die gesuchte Analytkonzentration cx berechnet. Die dem Resultat beigeordnete Messunsicherheit fasst alle Unsicherheitsbeiträge zusammen und wird üblicherweise als sog. erweiterte Messunsicherheit U(cx) mit einem Vertrauensniveau von 95 % angegeben. IDSERS – international vergleichbar Das Vertrauen in die Zuverlässigkeit von Messverfahren und damit auch ihre internationale Vergleichbarkeit wird durch regelmäßige Teilnahme an internationalen Vergleichsmessungen untermauert. Mit der Beteiligung der PTB und Einsatz von IDSERS an den Ringvergleichen IFCC-RELA 2010 [7] und EURAMET 1176 [8] wurde erstmals überhaupt ein Verfahren auf Basis der Ramanspektrometrie einer solchen Bewährungsprobe unterzogen. Ziel war die Bestimmung der Kreatininkonzentration in zwei unterschiedlichen, vom Veranstalter bereitgestellten Serumproben. Von den zwölf teilnehmenden Laboratorien, darunter vier Metrologieinstitute, haben zehn das aktuelle Referenzverfahren (IDMS) eingesetzt. Ein Vergleich der Messdaten aller Teilnehmer zeigt, dass die in der PTB mit IDSERS ermittelten Serumkonzentrationen des Kreatinins sehr gut mit dem Mittelwert der durch IDMS gemessenen Werte übereinstimmen (Abb. 3). Die Eignung und Leistungsfähigkeit der Methode als höherwertiges Messverfahren für die Metrologie in der Chemie wurde damit erfolgreich nachgewiesen. Die in Ringvergleichen bewerteten und begutachteten Normale für chemische Messgrößen fließen in öffentlich zugängliche Datenbanken ein. Kalibrier- und Messmöglichkeiten, die von den NMIs als nationale Standards bereitgestellt werden, sind in der CMC-Datenbank des Bureau International des Poids et Mesures (BIPM) zusammengefasst [9]. Höherwertige Messverfahren für eine Anzahl der wichtigsten klinischen Analyte enthält die Datenbank des Joint Committee for Traceability in Laboratory Medicine (JCTLM) [10]. Ein solcher Eintrag wird derzeit für den Einsatz von IDSERS zur Bestimmung von Harnsäure und Kreatinin in Serum realisiert. Die Entwicklungen auf diesem Gebiet sind damit aber noch nicht abgeschlossen. Laufende Arbeiten an der PTB gelten vor allem größeren Biomolekülen, für die eine metrologische Rückführungsstruktur bisher nur ansatzweise existiert. Von besonderem Interesse sind Messverfahren und Referenzmaterialien für die Bestimmung von Metalloproteinen, z. B. Transferrin oder Hämoglobin, die als Transportproteine für Eisen im Blutplasma wirken. Die Beiträge der PTB sind eingebunden in gemeinsame Forschungsprojekte verschiedener NMIs aus europäischen Partnerländern, die sich im „European Metrology Research Programme“ (EMRP) zusammengeschlossen haben [11]. Um größtmögliche Qualität der Ergebnisse sicherzustellen, werden dabei sowohl IDMS als auch die neue Raman/IDSERS-Technik eingesetzt.
Literatur Foto: © Dr. Rainer Stosch / Dr. Sabine Zakel |
L&M 4 / 2012
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |