|
Glycobiologie - Bakterielle Adhäsion an der Wirtszell-Glycocalyx
Glycobiologie - Bakterielle Adhäsion an der Wirtszell-GlycocalyxEin Platz an der Sonne
Prof. Dr. Thisbe K. Lindhorst und Mirja Hartmann, Otto Diels-Institut für Organische Chemie, Christian-Albrechts-Universität zu Kiel Wo immer Zellen mit der Außenwelt in Kontakt sind, z.B. im Bereich der Epithelzellen, wird die Zuckerdekoration ihrer Oberfläche von Mikroben als Ankerplatz genutzt. Über spezifische Proteine können sie ihre Anheftung initialisieren, in der Folge die Adhäsion verstärken und schließlich einen gut organisierten Biofilm ausbilden. Der Biofilm: bakterielle Persistenz Im Biofilm sind Bakterien einer oder verschiedener Spezies fest und irreversibel an eine Oberfläche adhäriert [1]. Ein selbst produzierter Zuckerschleim verbindet sie miteinander. Über diese Exopolysaccharidschicht können Bakterien durch einen Vorgang, der als „Quorum Sensing“ bezeichnet wird, miteinander in Kontakt treten und dies vorteilhaft nutzen. Biofilmbildung ist vielfach die Grundlage einer für Mikroorganismus und Wirt vorteilhaften Symbiose; dringen allerdings Mikroorganismen in neue Habitate vor oder verändert sich ihr Genmaterial auch nur geringfügig, so können Ungleichgewichte entstehen, auf die der menschliche Körper mit entzündlichen Krankheiten oder sogar Apoptose reagiert [2]. Warum heften sich Bakterien an menschliche Zellen? Vermutlich handelt es sich schlicht um einen idealen Platz für Vermehrung und Persistenz. Bakterien finden im Körperinneren stabile Bedingungen, z.B. geringe pH-, Temperatur- und Salzgehaltschwankungen und ein vielseitiges Angebot an Nährstoffen vor. Für die Anheftung an die hoch glycosylierte Oberfläche eukaryontischer Wirtszellen stehen Bakterien Kohlenhydrat-spezifische Tentakel als Werkzeuge zur Verfügung, die sogenannten Fimbrien, fadenförmige Proteinketten, die ein Bakterium in hundertfacher Ausführung auf seiner Außenseite trägt. Das erste Andocken: Proteintentakel binden Zucker
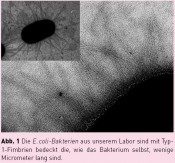
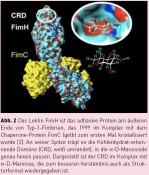
Für die Untersuchung bakterieller Adhäsion ist es nun wichtig zu verstehen, welche Rolle die Fimbrien-vermittelte molekulare Erkennung von Kohlenhydraten auf Zelloberflächen spielt. Tatsächlich tragen bakterielle Fimbrien, die aus einer Vielzahl einzelner „Fim-Proteine“ aufgebaut sind, an ihrer Spitze ein Protein, das auf Kohlenhydrat-Erkennung spezialisiert ist, ein „Lektin“. Die wenige Micrometer langen sogenannten Typ-1-Fimbrien tragen an ihrer Spitze das Lektin FimH, das Mannose-spezifische Adhäsion vermittelt. Mannose-spezifische molekulare Erkennung ist für die Adhäsion der uropathogenen Gram-negativen Escherichia coli-Bakterien (Abb. 1) an Epithelzellen besonders wichtig, weil Mannose auf verschiedensten menschlichen Zellen sehr häufig vorkommt. Bakterien, Geckos und Kletten – 3 Tieftaucher?
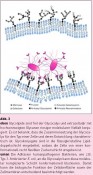
Für ein besseres Verständnis der Mechanismen bakterieller Adhäsion ist es hilfreich, sich die Natur der eukaryontischen Glycocalyx einmal genauer vor Augen zu führen. Es handelt sich um eine nanodimensionierte, in ihren molekularen Details schlecht überschaubare Schicht, welche die ganze Zelle umgibt. Modellhaft lässt sich diese „atmosphärische Umgebung“ der Zelle als Anordnung von Oligosaccharidbausteinen beschreiben, in der Zucker wie molekulare Antennen als Ligandenmuster aufgestellt sind (Abb. 3 oben). Dieses Gedankenmodell hat den Vorteil, dass es sich in In-vitro-Experimenten umsetzen lässt, wozu z.B. sogenannte Glycoarrays [4,5] verwendet werden können. Im „High-Throughput-Screening“-Verfahren können mittels Glycoarrays recht viele verschiedene Zucker-Rezeptor- Wechselwirkungen relativ schnell evaluiert werden. Solche Untersuchungen zeigen typischerweise, dass Kohlenhydrat-Protein-Wechselwirkungen erstaunlich schwach sind, so schwach, dass sich ihre biologische Signifikanz kaum erklären lässt. Allerdings kann man davon ausgehen, dass unterschiedliche Multivalenzeffekte für eine ausreichend feste und spezifische Kohlenhydrat- Erkennung sorgen [6]. Dabei ist es wichtig, die Physikochemie von Multivalenz in biologischen Systemen genau zu studieren und Multivalenzeffekte in Lösung von solchen auf Oberflächen zu unterscheiden. [7] Multivalenzeffekte auf Oberflächen zu bedenken, ist bei der Betrachtung bakterieller Adhäsion besonders relevant. Dabei erinnert das Szenario der Wechselwirkung hundertfach fimbriierter Bakterien mit der nanodimensionierten Glycocalyx-Oberfläche einer Wirtszelle an andere beeindruckende Adhäsionsphänomene, die in der makroskopischen Natur bekannt sind. Ein Paradebeispiel für erfolgreiche Adhäsion liefert der Gecko. Deep Impact: Sonnenuntergang auf der Zelloberfläche? Fimbrien-vermittelte Adhäsion an eine Wirtszell-Glycocalyx kann nicht ohne Folgen für die Zelle bleiben. Bestätigt sich unsere Hypothese über die makromolekularen Gesichtspunkte bakterieller Adhäsion, könnte dies wiederum entscheidende Bedeutung für die Glycocalyx-Biologie haben, denn eine tiefgreifende und weitreichende Wechselwirkung von Bakterien mit der eukaryontischen Glycocalyx z.B. könnte zu physiologisch kritischen Konsequenzen führen. Gerade die Flexibilität von Biomembran und extrazellulärer Matrix ist ja für die vielfältigen Zellfunktionen unerlässlich. Durch eine konformationelle Einschränkung von Zelloberflächen-Glycanen sind die Beweglichkeit von Membranglycolipiden und -glycoproteinen und damit auch Zelloberflächen- und Membraneigenschaften betroffen (vgl. Abb. 3). Wenn man nun davon ausgeht, dass die Glycocalyx-Funktion für die Zelle essentiell ist, so könnte ihr Verkleben unmittelbar pathologisch wirken. Dies ist eines der spannendsten Probleme in der Glycobiologie. Foto: © Prof. Dr. Thisbe Lindhorst
[1] Garrett, T.R. et al. (2008) Prog. Nat. Sci. 18, 1049-1056 |
L&M 1 / 2009
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |