|
Von 2D zu 3D
Von 2D zu 3DEine Technik hebt abEs ist nicht lange her, dass man mit Forschungsanträgen an die DFG für Projekte, die sich mit dreidimensionalen Zellkulturen (3D-Kulturen) beschäftigten, lausige Chancen hatte durchzukommen. Das lag wohl daran, dass die Gutachter die grundlegende Bedeutung und das Anwendungspotenzial der Technik schlicht nicht verstanden hatten: der Schreiber dieser Zeilen weiß, wovon er nach drei Dekaden der innovativen Produktion von retinalen Zellsphäroiden redet. Dies hat sich aufgrund des Aufkommens der Stammzellbiologie und des Tissue Engineerings, also von Technologien zur künstlichen Gewebezucht als Basis der regenerativen Medizin, ziemlich schlagartig verändert: Wir erleben derzeit einen wahren Hype der Kultivierung von Zellen in 3D. Dabei haben 3D-Zellkulturen eine lange Geschichte, ja, in Wahrheit hat die ganze Zellbiologie mit 3D-Zellkulturen begonnen (siehe z.B. Layer et al., 2001). Embryologen haben nämlich an der Wende zum 20. Jahrhundert alle mit dissoziierten Zellen aus Schwämmen, Seeigeln, Molchen und anderem Getier geforscht. Besonders aufschlussreich und historisch bedeutsam sind etwa Experimente von Wilson (Wilson, 1907; s. Abb. unten), bei denen er Schwämme vollständig in ihre Zellen zerlegt hat, um sie dann in Salzwasser in einer Glasschale unter leichtem Schütteln zu verfolgen.
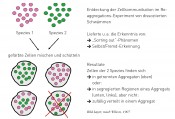
Die Reaggregation vereinzelter Zellen von Schwämmen markieren den Beginn der Zellbiologie (siehe weiter im Text). Es haben sich wieder vollständige Schwämme gebildet und, wenn er Zellen aus zwei verwandten Schwammarten einsetzte (welche farblich markiert waren), konnte er beobachten, dass sich die verschiedenen Zellen entweder in getrennten Reaggregaten wiederfanden oder innerhalb eines Aggregats in getrennten Bereichen absonderten. Damit war u.a. das Phänomen des „Sorting out“, d.h. die Zell-Zell-Erkennung entdeckt worden. Man könnte dies als Beginn der ganzen Zellbiologie ansehen. Zu nennen wären Holtfreter, dann Moscona und Steinberg und später meine Gruppe zur Reaggregation der Retina, ebenso auch Gierer mit Experimenten an Hydra u.v.m. (s. Layer et al., 2001). Sie haben diese Technik mit ihren verschiedenen Zellmodellen über die Jahrzehnte weitergetragen. Diese Forscher haben ihre Erkenntnisse immer auch als Schritte zur In-vitro-Gewebebildung betrachtet und sicherlich wesentlich zum heutigen Erfolg des Tissue Engineerings beigetragen. 3D-Kulturen blieben allerdings lange ein Spezialgebiet für Eingeweihte. Die Arbeiten waren nämlich zeitaufwändig (und damit teuer), was noch mehr für ihre Auswertung und Dokumentation zutraf. Kein Wunder also, dass Zellbiologen viel lieber mit 2D-Kulturen arbeiteten. Dass diese aber mit der natürlichen Gewebeumgebung nicht mehr viel zu tun hatten, war wenig bedacht worden. Erst Stammzellbiologen, als sie ihre Zellen in vitro stark vermehren wollten, sind auf die Vorzüge der Reaggregationstechnik (bzw. Sphäroidtechnik) wieder aufmerksam geworden und haben sie auf breiter Basis nun zum Hype gemacht. So hat kürzlich die Zucht von Minigehirnen aus Stammzellen im Labor von Jürgen Knoblich nach deren Publikation in Nature weltweit große Wellen geschlagen (Lancaster et al., 2013). Damit sind spätestens jetzt 3D-Kulturen wieder hoffähig geworden. In den 80er-Jahren kamen mehr und mehr Erkenntnisse hinzu, dass Zellen im Zellverband stark von ihrer jeweiligen Extrazellulärmatrix (ECM) abhängen. Es war die Zeit der Entdeckung von Zelladhäsionsmolekülen (NCAM, die IGSF-Familie, Cadherine u.v.m.), von riesigen Interzellularproteinen wie Laminin und Fibronektin und von vielerlei membranständigen Rezeptor- und Signaltransferproteinen wie den Integrinen. Vielleicht hier wieder bemerkenswert: Auch die ersten Zelladhäsionsmoleküle wurden mit der Reaggregationstechnik entdeckt. Viele dieser ECM-Stoffe enthalten Zuckergruppen (Polysaccharide), sind also Glycoproteine oder Glycane, die durch Einlagerung von viel Wasser zum Volumen, besonders aber auch den mechanischen Eigenschaften wie etwa zur Elastizität, Steifheit etc. der jeweiligen Gewebe maßgeblich beitragen. So ist es nicht erstaunlich, dass „Gewebeingenieure“, die heute künstlich ein Gewebe mithilfe von Stammzellen herstellen wollen, auf geeignete Polymerstoffe angewiesen sind, um die Eigenschaften der natürlichen ECM-Komponenten teilweise oder ganz in vitro zu ersetzen. Biokompatible Materialien zu entwickeln, die in der 3D-Gewebekultur, aber natürlich vor allem auch bei einer Gewebeimplantation in den Patienten als Gerüste geeignet sind, stellt einen inzwischen bedeutenden Forschungszweig dar, ohne den die regenerative Medizin nicht zum Erfolg werden könnte. Der nachfolgende Artikel zeigt ein hoffnungsvolles Beispiel einer solchen Entwicklung der Biomaterialforschung und zeigt auch, dass man inzwischen bei uns in Deutschland die Potenz von 3D-Zellkulturen erkannt hat.
Literatur Foto © panthermedia.net| Danilo Ascione, ersler dmitry |
L&M 2 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |