Leistungsfähigkeit, Ernährungssteuerung und RegenerationGuter ZuckerAnalyse und Interpretation von Creatinkinase-Werten, Harnstoff- und Harnsäurespiegeln sowie verschiedenen Elektrolyt- und Spurenelementekonzentrationen im Serum wie Magnesium, Eisen, Kalium, Zink, Natrium und Calcium gehören zum etablierten Instrumentarium der Trainingssteuerung im Leistungssport. Auch die Durchführung einer Ausdauerleistungs- diagnostik mit der Erhebung von Laktatkonzentrationen, Pulsfrequenzen oder VO2-max-Messungen gehören zum ständigen Repertoire. Die Entleerung der Energiespeicher durch häufigen intensiven physischen Stress führt neben hohen Laktatkonzentrationen auch zum Anstieg des kognitiv leistungshemmenden Ammoniaks [1]. In letzter Zeit gibt es allerdings deutliche Hinweise, dass diese Parameter alleine nicht ausreichen, um innere Bremsen beim Erreichen des physischen Optimums zu entdecken. In den Spielsportarten birgt außerdem der „Gruppenzwang“ weitere Gefahren, die eine individuelle Betrachtung der bestehenden Probleme erschweren.
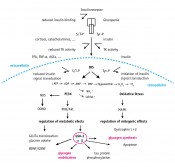
Abb.1 Ein funktionierender und hochsensibler Insulinrezeptor garantiert die Aufnahme von Glukose über den insulinabhängigen Glukose-4-Transporter (GLUT 4) in die Zelle. Im Inneren der Zelle wird (im Zitratzyklus) ATP erzeugt oder es werden Glykogenspeicher angelegt. In den folgenden Schritten wird ATP verbraucht und recycelt. Erst im anaeroben Stoffwechsel steigen Laktat, Harnstoff und Ammoniak an [2]. Physical exercise stress führt im letzten Schritt zu oxidativem Stress und vermehrter Belastung durch freie Radikale Einflussfaktoren der physischen Leistungsfähigkeit Komplementär zu sportmedizinischen Leistungstests und Spielsportanalysen der jeweiligen sportartspezifischen Trainerteams vermag eine detaillierte biochemische Beleuchtung der internistischen Blutbilder wertvolle zusätzliche Fakten in die Trainingssteuerung mit einzubringen. Über die Betrachtung einzelner Laborwerte und ihrer jeweiligen oberen und unteren Grenzwerte hinaus zeigen neue Erkenntnisse aus den Disziplinen Neurochemie und Biochemie, dass die Vielzahl scheinbar isolierter Parameter in einem größeren gemeinsamen Wechselspiel zueinander steht. So können Leberwerte, Fettwerte, Laborparameter des Zuckerstoffwechsels, des Eisens, der Mineralstoffe und der Vitamine wertvolle Einsichten eröffnen. Das Verhältnis dieser Laborparameter untereinander erlaubt weit reichende Aussagen über Energiestoffwechsel, Stresstoleranz, Regenerationspotenzial, Verletzungsanfälligkeit und Leistungsfähigkeit bzw. Leistungsabfall. Steuerungen und Asymmetrien im Energiehaushalt, Homöostasestörungen sowie relative Zuckerverwertungsstörungen spiegeln sich schon sehr früh in relativen Laborwertschwankungen auch ohne Grenzwertüberschreitungen wider. Die Basisgleichung für die zellulären Prozesse im Leistungsstoffwechsel und in Regenerationsphasen sieht dabei wie folgt aus: Voraussetzung aller regelrechten und ökonomischen Abläufe im Stoffwechsel des Organismus ist ein effizienter Nährstofftransfer. Im Besonderen die Glukoseverwertung spielt eine entscheidende Rolle. Der zelluläre Energieträger ATP überträgt seine gespeicherte Energie in Form des dritten Phosphats auf andere Moleküle unter Bildung eines phosphorylierten Energieträgers bzw. Metaboliten (z.B. Glukose-6-phosphat, Fruktose-1-6-diphosphat u.a.) und kann sein Abbauprodukt ADP selbst immer wieder über Kreatinphosphat regenerieren. Dies ist die Voraussetzung für Muskelkontraktion. Bei hoher Leistungsanforderung kommt es jedoch zu einem sukzessiven Abbau zu Nukleotiden, die schließlich unter anaeroben und chronisch-ischämischen Bedingungen zu toxischen Endprodukten wie Ammoniak und Harnsäure führen. Ein weiteres Endprodukt ist das Superoxidradikal, das, im Überschuss produziert wie z.B. durch falsche Ernährung oder bei einer Infektion, die molekularen Strukturen der Zelle zerstört. Unter diesen Bedingungen eines Sauerstoffmangels springt der Hypoxia-inducible factor 1-alpha (HIF-1-alpha) ein (dieser neue Parameter könnte für die Trainingssteuerung bedeutsam werden), um das System so gut wie möglich zu schützen und den anaeroben Extrembedingungen anzupassen [3].
Abb.2 Citratzyklus bei physiologischer Insulinstoffwechsellage. 1. Schritt Ausgangspunkt für die ATP-Bildung sind die Stoffwechselwege Glykolyse und Fettsäureabbau, die in den Zitratzyklus münden (Abb. 2) und die dabei entstandenen Reduktionsäquivalente NADH bzw. FADH in die Atmungskette einschleusen. Für die Bildung des Energieträgers ATP bei akutem Energiebedarf (Glykolyse) besteht die essenzielle Notwendigkeit, dass Glukose vom Äußeren der Zelle in ihr Inneres gelangt. Dieser Schritt benötigt auf der Oberfläche von Muskelzellen einen Insulinrezeptor, durch dessen Aktivierung im Inneren der Zelle eine Reaktionskaskade in Gang gesetzt wird, die schließlich den Glucose-4-Transporter (GLUT4) aktiviert. Jetzt kann Glukose in die Zelle aufgenommen werden [4]. Durch Überfrachtungen mit Kohlenhydraten können bereits an dieser Schlüsselstelle des Energiestoffwechsels erhebliche Störungen einer Insulinresistenz-Symptomatik auftreten [5]. 2. Schritt Regelmäßig wird in der Hochleistungssportmedizin ein großer Fokus auf die Glykogenspeicher gerichtet, deren darin enthaltene Glukose zur Energiegewinnung abgebaut wird (s.o.). Es wird dabei immer betont, dass gut gefüllte Glykogenspeicher ein Garant für Hochleistung sind. Die „Füllung“ dieser Energiespeicher und die spätere Mobilisierung der gespeicherten Energie sind jedoch abhängig von stabilen Insulinstoffwechsellagen mit funktionierenden Insulinrezeptoren und freien Insulinsignalwegen ins Innere der Zelle. Der kritische Punkt einer Überschwemmung des Organismus mit Kohlenhydraten ist, dass nach einem Überschießen der Insulinantwort und völliger Entfernung der Glukose aus dem Plasma eine Hypoglykämie folgt, die eine schnelle Nahrungsaufnahme mit konsekutiver Hyperglykämie und über den Hypothalamus gesteuert erneut eine Insulinsekretion einleitet. Diese Wellenbewegung der Insulinantwort destabilisiert die gesamte Stoffwechsellage. Repetitiv erhöhtes Insulin aber verhindert den Abbau von Fettsäuren aus Fettzellen. Eine ketogene Stoffwechsellage , die nun die Energie für eine Dauerleistung bereitstellen könnte, wird so verhindert. Hyperglykämie, Hyperinsulinämie und partielle Insulinresistenz verhindern die regelrechte Anlage von Glykogenspeichern und das perfekte Timing der Glykogenmobilisation (Abb. 3).
Abb.3 Insulinkaskade mit Glykogeneinlagerung bzw. -mobilisation. 3. Schritt Der Abbau von ATP zu ADP und AMP spiegelt sich im Muskelsystem durch den Anstieg der Creatinkinase (CK) wider. Über Kreatinkontingente des Organismus (ca. 150g) wird verbrauchtes ADP aus dem Cytoplasma innerhalb der Mitochondrien wieder zu ATP recycelt. 4. Schritt Wenn ATP bei intakter Stoffwechsellage verbraucht wird, wird das entstehende ADP immer wieder regeneriert. Kommt es jedoch zu einer Versorgungskrise, wie es z.B. bei sehr häufigen intensiven Belastungen passiert, entstehen zahlreiche Metaboliten und Abbauprodukte. Dabei kommt es zu einer Verschiebung der Gleichung in Richtung leistungslimitierender Metabolik. Der Laktat/Pyruvat-Quotient ist ein wichtiger Indikator für das Verhältnis von aerob zu anaerobem Abbau von Glukose und Fettsäuren. Auch die leistungsbegrenzende Rolle von Ammoniak ist bekannt und beschrieben [6]. Ammoniak steigt im Steady-State der Laktatbelastung weiter an und wirkt subjektiv und messbar kognitiv limitierend [7]. Ein weiterer Metabolit im Leistungsenergieverbrauch ist Harnstoff, der als Ausscheidungsprodukt des im Abbau von Aminosäuren wie Glutamin anfallenden Ammoniaks dient.
Abb.4 Verlust der Glukose- und Insulinsensitivität führt zum Versagen der Verlagerung des Glukose 4 Transporters (GLUT 4) in die Zellmembran und zu dessen Funktionsverlust, während im Inneren der Zelle Glukose- und ATP-Mangelerscheinungen überhand nehmen. Im Zellinneren entsteht unter diesen Bedingungen vermehrt Laktat, Ammoniak, Harnsäure, oxidativer Stress und der HIF-1-alpha. Außerhalb der Zelle und im Blut belastet nicht verwertete Glukose die Leber, den Fettstoffwechsel und über Glycierungen die Hämoglobinwerte 5. Schritt* Die Harnsäure ist dagegen das Abbauprodukt von Nukleotiden wie ATP und dient als Antioxidans (s.o.). Harnstoff und Harnsäure steigen unter Bedingungen des anaeroben Energiestoffwechsels sowie unter Glukose- und Fruktose-Überfrachtung an. Fruktose führt direkt zum Anstieg des Blutdrucks und der Harnsäure und hemmt die physiologischen Wirkungen von Stickstoffmonoxid (NO). Stärke, Glukose und Fruktoseüberfrachtungen führen zu relativen Insulinresistenzbedingungen mit reduzierten Aktivitäten des insulinabhängigen GLUT-4-Transporters. Dies korreliert intrazellulär mit Energie- und ATP-Mangel und verändert die regelrechte Anlage von Glykogenspeichern. Gleichzeitig findet sich hier die Ursache für steigende Fettwerte, vermehrt glykiertes Hämoglobin (HbA1c) und Störungen des Leberstoffwechsels (γ-GT). 6. Schritt Kohlenhydrate schädigen Insulin produzierende Zellen durch oxidativen Stress. Die ultimativen Leistungs- und Regenerationsbremsen stellen in dieser Energiestoffwechsel-Basisgleichung die Endprodukte der freien Radikale (ROS) dar, allen voran das Superoxidradikal O2·– [8]. Es entsteht im Normalfall in geringem Maße (2–3%) in der Atmungskette beim Durchlaufen der Elektronen durch die Komplexe I–IV, bis sie korrekt auf Sauerstoff übertragen werden. Das Herausfallen aus dieser Kette und die direkte Übertragung auf Sauerstoff führen zur Bildung des Superoxidradikals. Das wird aber ebenfalls im Normalfall durch die SOD abgefangen. Eine Überschwemmung durch zu viele freie Radikale, wie sie z.B. bei zu viel schnell verfügbarer Nahrung wie kurzkettigen Kohlenhydraten auftreten kann, führt jedoch zu einer zusätzlichen und nicht mehr kontrollierbaren Radikalbildung und damit zu seiner Schädigung und Schwächung [9]. Das Superoxidradikal entsteht unter intensivem physischen Stress und kann seine Schädigung im Gewebe fortsetzen, v.a. mit Eisen, das aus dem Abbau von Erythrozyten stammen kann. Unter normalen Bedingungen kann es aber auch bei der Immunabwehr den Makrophagen beim Abtöten von Keimen helfen und hat daher ebenfalls eine den Organismus schützende Funktion. 7. Schritt Reaktionen dieser Superoxidradikale mit NO, welches konstitutiv vorhanden ist und in physiologischer Dosierung gefäßerweiternd wirkt, führen zur Bildung von Peroxynitrat (OONO–), das zu den größten Zerstörern zellulärer Substrukturen und Makromolekülen zählt. Physiologisch nicht abgefangenes Superoxid (Abb. 4; Schritt 6) reagiert schließlich zu Wasserstoffperoxid, das mit Eisen (Fe++) zur Bildung des OH·–Radikals führt, welches als das aggressivste Radikal angesehen werden muss, gegen das es keine biologische Abwehr gibt. Diese anaeroben und ischämischen Stoffwechselbedingungen rufen den HIF-1-alpha auf den Plan. Im Dienste eines akuten Schutzsystems kann er kurzfristige Anpassungen ermöglichen. 8. Schritt Die Stoffwechselbelastungen dieses Schrittes entwickeln sich synchron am Regelkreis der Zuckerverwertung am Insulinrezeptor. Während die Einschleusung der Glukose über den Glukosetransporter ins Innere der Zelle stockt, wird überschüssiger Zucker außerhalb in Fett umgebaut und führt zur Glykierung wichtiger Enzyme, wird unter anderem belastend an Hämoglobin angehängt und schädigt den Leberstoffwechsel (γ-GTé, Cholesterin é, HbA1c é). Glykierungsprodukte werden als AGE (Advanced Glycated Endproducts) bezeichnet und sind sehr gut messbar. Als Messparameter hierfür steht das glykierte Hämoglobin (HbA1c) zur Verfügung. Fazit Um Leistungs-, Energie- und Regenerationsstoffwechsel zu optimieren, leiten sich zwei Hauptziele ab: Je mehr ATP intrazellulär zur Verfügung steht bzw. je besser ATP reguliert wird und je weniger freie Radikale entstehen bzw. je effektiver sie entsorgt werden, umso stabiler und robuster ist der Organismus. Der ATP-Haushalt ist umso besser, je mehr Glukose bzw. freie Fettsäuren in der Zelle verfügbar sind. Je ökonomischer die Insulinausschüttung und der Insulinrezeptor arbeiten, umso stabiler zeigt sich das System und umso weniger kann eine zu hohe Plasmakonzentration an freier Glukose Zellwände, Membranen, Hämoglobin und andere Enzyme und Proteine mit „Glykierungen“ belasten. Bisher „unauffällige“ Normwerte für Diabetiker mit HbA1C-Werten ab 6,1 sind veraltet. Für gesunde Menschen und vor allem Hochleistungssportler sind „jungfräuliche“ HbA1C-Werte von unter 5 anzustreben. Werte von 5,5 sind schon gleichbedeutend damit, dass die optimale Sauerstoffbindung und Abgabekapazität wesentlich beeinträchtigt ist, da aktive Zentren des Hb tatsächlich „verschmiert“ sind und der Energiestoffwechsel belastet ist. Das bedeutet, dass bei Werten über 5 die Glukoseverwertung nicht optimal läuft. Es kann zu partiellen Insulinresistenzen und daraus resultierend zu Leistungsminderung und verzögerte Regeneration kommen [10]. Bild: © fotolia.com | baibaz |
L&M 5 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |