|
Forscher
>
Prof. Dr. Alexander Schiller
>
Mit biomimetischer Signaltransduktion zu lichtsensiblen Polymervliesen und molekularen Rechnern
Mit biomimetischer Signaltransduktion zu lichtsensiblen Polymervliesen und molekularen RechnernElegant und präzise gesteuertNeuronale Funktion in Synapsen besteht im Wesentlichen aus Signal generierung durch Freisetzung von kleinen Molekülen (Neurotransmitter), selektiver Signaldetektion sowie deren Prozessierung. In allen drei Punkten entwickelt die Arbeitsgruppe von Dr. Schiller Konzepte zur Modellierung mit anorganisch-chemischen, sensorischen und materialwissenschaftlichen Werkzeugen. Signalgenerierung – NO- und CO-freisetzende Moleküle und Materialien In diesem Projekt werden optimierte NO/CO-Komplexe hergestellt, die durch einen externen Auslöser (wie beispielsweise Bestrahlung) Stickstoffmonoxid (NO) oder Kohlenstoffmonoxid (CO) freisetzen (Abb. 1) [1, 2]. Diese NO/CO-freisetzenden Moleküle (NORMs & CORMs) erfüllen Anforderungen wie Wasserlöslichkeit, gesteuerte NO/CO-Abgabe und Unbedenklichkeit der Komplexe sowie ihrer Abbauprodukte. Um den Mechanismus der CO-Abgabe zu untersuchen, werden die Nitrosyl-/Carbonylkomplexe mit verschiedenen Übergangsmetallen, Ligandenumgebungen und variierenden NO/CO-Gehalten synthetisiert. Besonders photoaktive Metall-Nitrosyl-/Carbonylkomplexe werden durch ein Ligandendesign für die Anregung im sichtbaren Licht ausgestattet (Abb. 1) [3, 4]. Nitrosyl- und Carbonylkomplexe von Mangan, Ruthenium und Rhenium in niedrigen Oxidationsstufen sind geeignet, bei Belichtung NO oder CO freizusetzen. Es werden aber auch NORMs und CORMs mit neuartigen Funktionalitäten entwickelt, z.B. eine schaltbare Löslichkeit oder lumineszierende und ramanaktive Detektorsysteme. Die Analyse der physikochemischen Prozesse während der CO-Abgabe führt in einer regelkreisanalogen Rückkopplung in Kombination mit zeitabhängigen Dichtfunktionaltheorie-Rechnungen zu verbesserten NORMs & CORMs [3, 4]. Diese Komplexe werden in biologischen Systemen in der Forschergruppe FOR 1738 „Häm und Hämabbauprodukte“ eingesetzt.
Abb.1 NO- und CO-freisetzende Moleküle (NORMs und CORMs, NO- and CO-releasing molecules), basierend auf Nitrosyl- und Carbonylverbindungen von Mangan(I) und Ruthenium(II). Bis auf CORM-1 (Mn2(CO)10) wurden alle in der AG Schiller entwickelt.
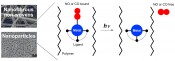
Im Gegensatz zu wasserlöslichen NORMs und CORMs ist es in einigen Fällen von Vorteil, unlösliche NO/CO-abgebende Materialien (NORMAs & CORMAs) zu verwenden, die nach der NO/CO-Abgabe zusammen mit den immer noch aktiven Zersetzungsprodukten entfernt werden können (Abb. 2) [1, 2]. Hierfür werden bekannte und neue Metall-Nitrosyl/Carbonyl-Komplexe für die Einbettung in Polymere genutzt, damit Partikel [5] und Nanofaservliese mittels Elektrospinning [4, 6, 7] generiert werden können.
Abb.2 NO- und CO-freisetzende Materialien (NORMAs und CORMAs, NO- and CO-releasing materials), basierend auf nichtkovalent immobilisierten Nitrosyl- und Carbonylverbindungen von Mangan(I) und Ruthenium(II) in Nanopartikeln und elektroversponnen ungewebten Vliesen. Bestrahlung mit Licht ermöglicht die Freisetzung von NO und CO aus den polymeren Materialien.
Voraussetzung für einen Einsatz von NO und CO in medizinischen Anwendungen ist es, das Gas kontrolliert und ausschließlich am gewünschten Ort zu applizieren [1, 2]. Gemeinsam mit einem interdisziplinären Team konnten wir lichtsensible Polymervliese vorstellen, die genau das möglich machen. Sie setzen kontrolliert NO oder CO frei und sind damit als Material für biomedizinische Anwendungen geeignet [4, 6, 7]. Entwickelt wurde die Vliese im Rahmen der DFG-Forschergruppe „Häm und Häm-Abbauprodukte“ der Friedrich-Schiller-Universität Jena (www.hhdp.u Signaldetektion – supramolekulare analytische Chemie mit Boronsäurerezeptoren in Wasser Die Boronsäuregruppe zusammen mit Fluoreszenzindikatoren wird sehr erfolgreich in Sensormolekülen für die Erkennung von Zuckern, Nukleotiden, Catecholen und Hydroxylcarbonsäuren eingesetzt [8–10]. Ziel dieses Projekts ist die Synthese und Charakterisierung neuer fluorierter Boronsäuren ohne fluoreszierende Einheit (Abb. 3). Diese werden zur Detektion und Unterscheidung von Diolverbindungen und anorganischen Anionen in physiologischem Medium mittels 19F-NMR verwendet. Die Anwesenheit eines Fluoratoms, z.B. in Fluorobenzenboronsäure, stellt einen sehr empfindlichen NMR-Sensor für die Umgebung der Boronsäure dar. Wenn ein Zucker im physiologischen Medium bindet, shiftet das 19F-NMR-Signal aufgrund der entstandenen Zucker-Boronat-Verbindung. Kommerziell erhältliche fluorierte Benzenboronsäuren nutzen wir, um Wasserlöslichkeit, Säurestärke und Selektivität gegenüber Bioanalyten zu testen.
Abb.3 Fluorierte Benzenboronsäuren auf der Basis von Pyridiniumsalzen reagieren mit Diolen über die Boronsäureeinheit. Der Marker Fluor erfährt einen Shift im 19F-NMR aufgrund der Konjugation über die Benzeneinheit mit der sp2/sp3-hybridisierten Boronsäure.
Hauptsächlich aber werden neue fluorierte Boronsäurerezeptoren auf Basis von Pyridinium- und Imidazoliumsalzen synthetisiert. Diese versprechen eine gute Wasserlöslichkeit und Analytselektivität in Abhängigkeit von der Anzahl der Boronsäuregruppen. Eine Musteranalyse mit Sensorarrays aus ausgewählten fluorierten Boronsäuren generiert die Selektivität gegenüber speziellen Analyten. Dies geschieht mittels multivariater Analyse, der Generierung von Barcodes und einer audiovisuellen Darstellung der 19F-NMR-Signale [11]. Signalprozessierung – molekulare Logik und Rechnen in der Diagnostik Seit der Einführung des ersten molekularen UND-Gatters durch A.P. de Silva von der Universität Belfast [12] entwickelte sich die molekulare Logik zu einem Forschungsgebiet, in dem große Schaltungen arithmetische Operationen durchführen oder sogar Mikrotiterplatten für „Tic-Tac-Toe“-Spielzüge auf Basis von DNA-Logikgattern genutzt werden können [13]. Eine anwendungsorientierte Weiterentwicklung erfährt das Feld derzeit durch die Möglichkeit, chemische Sensoren als Logikgatter für die medizinische Diagnostik zu nutzen. Mediziner verwenden klinische Parameter oft in binärer Form, d.h., sie sind nicht unbedingt an den exakten numerischen Werten interessiert. Vielmehr verknüpfen sie Ja/Nein-Informationen mit Logikoperatoren wie ODER und UND, um zu einer ersten Diagnose zu gelangen. Ein gutes Beispiel ist die Bestimmung des humanen Choriongonadotropins in Schwangerschaftstests. Sind mehrere Analyten zu berücksichtigen, kann die binäre Antwort mehrerer Sensoren zu einer finalen Diagnose verknüpft werden. Die Integration molekularer Logikelemente (Sensoren) in komplexe Schaltungen birgt aber einige Herausforderungen: (1) Logikoperationen in Lösung sind aufgrund geringer räumlicher Organisation limitiert. (2) Die Art der Ausgabe macht es schwierig, diese in ein nächstes Gatter zu überführen. (3) Viele molekulare Logikgatter benötigen verschiedene chemische Spezies als Eingaben und produzieren eine breite Palette an Ausgaben, was eine Verbindung der Gatter erschwert. (4) Die Akkumulierung chemischer Ein- und Ausgaben verhindert ein Rücksetzen. Kombinierte Ansätze aus Chemie und Informatik sind notwendig, um den Herausforderungen in der Multianalytdiagnostik und molekularen Logik entgegenzutreten. In der Arbeitsgruppe arbeiten wir mit Sensoren auf Mikrotiterplatten, um eine chemische Plattform für eine komplexe Logik zu konstruieren, die einen diagnostischen Finalwert ausgibt. Der Ansatz kombiniert die Synthese von neuen Fluoreszenzsensoren für Zucker, Anionen und Gasotransmitter wie NO oder CO mit einem Algorithmus für chemische Ein- und Ausgaben auf Mikrotiterplatten [8–10, 14–16].
Abb.4 a) Der Zwei-Komponenten-Sensor mit einem Diboronsäurebipyridinium-Salz (BBV, Input A, rot) und einem Fluoreszenzfarbstoff (8-Hydroxypyren-1,3,6-trisulfonsäuretrinatrium Salz, HPTS, blau) lässt sich als logische Funktion-Implikation (IMP) beschreiben. Der zweite Input ist ein Zucker wie z.B. Fruktose (Input B, grün). HPTS fluoresziert im wässrigen Puffer selbst (A = 0, B = 0, Output = 1), ebenso bei der Präsenz von Fruktose (A = 0, B = 1, Output = 1). BBV löscht die Fluoreszenz (A = 1, B = 0, Output = 0) – außer Fruktose ist zusätzlich vorhanden und reagiert mit der Boronsäureeinheit zu einem Boronat (A = 1, B = 1, Output = 1). (b) Die Verknüpfung der logischen Gatter beginnt mit dem Auslesen der Inputwerte: Fluoreszenzintensität wird gemessen. Ein Verknüpfungsalgorithmus entscheidet über die Weitergabe von Information in Form von Chemikalien in weitere Wells der Mikrotiterplatte. (c) Emissionsspektren aller Luminophoren: blau, Nanopartikel für Tic-Tac-Toe; grün, HPTS; rot, Nanopartikel für Tic-Tac-Toe, HEPES-Puffer, pH = 7,4, 0,1 mol/L, Anregungswellenlänge: 415nm.
Im Jahr 2014 konnte der erste molekulare Rechner auf Zuckerbasis (Abb. 4) [10, 15] veröffentlich werden. Die klassische binäre Logik, nach der ein konventioneller Computerchip arbeitet, basiert auf einfachen Ja-/Nein-Entscheidungen – entweder fließt ein Strom zwischen zwei Punkten eines elektrischen Leiters oder nicht. Diese Spannungsunterschiede werden in „0“ und „1“ codiert und lassen sich mittels logischer Gatter – den Booleschen Operatoren wie UND, ODER, NICHT – miteinander verknüpfen. Auf diese Weise ist eine Vielzahl unterschiedlicher Signale und komplexer Schaltungen möglich. Diese logischen Verknüpfungen (Konkatenierung) lassen sich aber auch mithilfe chemischer Substanzen realisieren. Für den „Zuckercomputer“ nutzen wir mehrere Komponenten: einen fluoreszierenden Farbstoff und einen sogenannten Fluoreszenzlöscher. Liegen beide Komponenten vor, so kann der Farbstoff seine Wirkung nicht entfalten und es gibt kein Fluoreszenzsignal. Kommen jedoch Zuckermoleküle ins Spiel, reagiert der Fluoreszenzlöscher mit dem Zucker und verliert so seine Fähigkeit, das Fluoreszenzsignal zu unterdrücken, was den Farbstoff zum Fluoreszieren bringt. Je nachdem, ob Farbstoff, Fluoreszenzlöscher und Zucker als Signalgeber vorliegen, resultiert ein Fluoreszenzsignal – „1“ – oder kein Signal – „0“ (Abb. 4). Im „Zuckercomputer“ werden nun die chemischen Reaktionen mit Computeralgorithmen konkateniert, um komplexe Informationen zu verarbeiten. Wird ein Fluoreszenzsignal registriert, gibt der Algorithmus vor, was als Nächstes in das Reaktionsgefäß pipettiert werden soll. Auf diese Weise werden die Signale nicht wie im Computer in einen Stromfluss, sondern einen Materiefluss übersetzt und verarbeitet. Die Funktion der chemischen Rechenplattform wurde mit zwei Settings getestet: (1) Lösen einer Rechenaufgabe (Addition von 10 + 15) [15] und (2) Spielen von Tic-Tac-Toe [14]. Für die Rechenaufgabe braucht der „Zuckercomputer“ ca. 40 min. Das Ziel ist es nicht, eine chemische Konkurrenz zu gängigen Computerchips zu entwickeln. Die Rechenplattform kann sich im Bereich der medizinischen Diagnostik durchsetzen. So ist es beispielsweise denkbar, die chemische Analyse mehrerer Parameter aus Blut- oder Urinproben über die molekularlogische Plattform zu einer finalen Diagnose zu verknüpfen und damit Therapieentscheidungen zu ermöglichen.
Im Jahr 2015 gelang es uns, mit dem „Zuckercomputer“ Tic-Tac-Toe zu spielen [14]. Ziel des Spiels ist es, drei Punkte oder drei Kreuze in eine Reihe zu bekommen, wobei bei nur neun Spielfeldern recht kurze Partien gespielt werden. Im Vorteil ist stets Spieler A, der das Spiel eröffnet. Nur er hat die Chance, die Partie für sich zu entscheiden. Spieler B kann lediglich ein Remis erreichen. Das Spiel Tic-Tac-Toe war das erste grafische Computerspiel, das 1952 an der Universität Cambridge auf einem Rechner lief. Die Eleganz des „Zuckercomputers“ allerdings liegt im spektralen Multiplexing, das es in der elektronischen Informationsverarbeitung gar nicht gibt. Während herkömmliche Computer auf dem simplen Modell beruhen, dass entweder ein Strom fließt oder nicht, können die Bits des „Zuckercomputers“ verschiedene Farben annehmen. Diese zusätzliche Informationsdimension können wir in der AG lesen, nutzen und auch Ausblick Signalgenerierung. Wir arbeiten weiter mit neuen Ru-NO- oder Mn-CO-Komplexen und deren Immobilisierung in ungewebten Vliesen. Der integrierte „Lichtschalter“ wird zusammen mit Lichtleitern genutzt, um eine „ferngesteuerte“ Freisetzung von NO oder CO zu ermöglichen. Ebenso werden die Vliese auf ihre Tauglichkeit hin als medizinisches Pflaster zur Unterstützung bei der Wundheilung untersucht. Signaldetektion. Die Kombination von fluorierten Boronsäuren nutzen wir momentan, um so genannte „Fingerabdrücke“ von Bioanalyten zu erstellen. Die Selektivität und Empfindlichkeit der Rezeptoren kann durch neue audiovisuelle Methoden drastisch erhöht werden. Signalprozessierung. Die vorgestellten Studien in der AG Schiller sind erste Demonstrationen einer kombinierten Verarbeitung von Materie und Informationen. Die Addition von natürlichen Zahlen und das Spielen von Tic-Tac-Toe zeigen die Möglichkeiten, die die Kontrolle chemischer Eingaben mit einem externen Verknüpfungsalgorithmus bietet. Dies ermöglicht eine Logikgatterverknüpfung, ohne dass eine Ein-/Ausgabehomogenität der einzelnen Logikgatter notwendig ist. Diese Strategie kann auf eine Vielzahl anderer molekularer Logikgatter ausgedehnt werden und erlaubt es, Schaltungen größter Komplexität zu entwerfen. Besonders auf dem Gebiet der Multianalytdiagnostik in der Medizin kann das neue Impulse liefern.
Literatur Abbildungen: © A. Schiller; Titelbild: © J.-P. Kasper/FSU Jena |
L&M 10 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |