|
Lichtmikroskopische Bilder aus lebenden Zellen mit grenzenloser Schärfe
Lichtmikroskopische Bilder aus lebenden Zellen mit grenzenloser SchärfeDer Chemie-Nobelpreis geht in diesem Jahr an den deutschen Wissenschaftler Stefan Hell sowie die US-Amerikaner Eric Betzig und William Moerner. Sie erhalten die Auszeichnung für die Entwicklung der superauflösenden Fluoreszenzmikroskopie. Das gab die Königlich-Schwedische Akademie der Wissenschaften in Stockholm am 8. Oktober 2014 bekannt. Das Lichtmikroskop ist seit dem 17. Jahrhundert wohl eines der wichtigsten Werkzeuge zur Gewinnung neuer wissenschaftlichen Einsichten aus dem Mikrokosmos. Durch stetige Weiterentwicklung der instrumentellen Technologie gelang es den Forschern in der Vergangenheit, immer kleinere Objekte zu untersuchen. Doch schon relativ früh stieß man auf eine natürliche Grenze: Licht breitet sich als Welle aus und wird gebeugt. Deshalb kann ein Lichtmikroskop nur Details auflösen, die mindestens eine halbe Wellenlänge (200 Nanometer) voneinander entfernt sind. 1873 von Ernst Abbe entdeckt und in einer Formel festgehalten, erschien dieses Gesetz unüberwindbar.
Objektgröße und Auflösung im Vergleich Bild: St. Hell, l&m 5/07
Um feinere Strukturen untersuchen zu können, musste entweder die Wellenlänge der verwendeten elektromagnetischen Strahlung verkleinert werden (in Richtung Ultraviolett- oder Röntgenstrahlung) oder ganz andere Abbildungsstrategien mussten her: Die Elektronen- sowie die Rastersondenmikroskopie mit ihrer höheren Auflösung haben maßgeblich zum Fortschritt des 20. Jahrhunderts beigetragen haben. Hiermit handelte man sich jedoch auch substanzielle Nachteile ein: Intakte oder sogar lebende Zellen können durch diese Verfahren nicht abgebildet werden, da sie einerseits auf Oberflächen begrenzt sind und meist ein Vakuum erfordern. Der Blick in das Innere von Zellen ist diesen Methoden verwehrt. Es bleibt das Lichtmikroskop. Stefan Hell hat als Erster – und den Zweiflern in der deutschen wissenschaftlichen Community zum Trotz – einen Weg gefunden, die Abbe'sche Grenze im Fluoreszenzmikroskop, dem wichtigsten Mikroskop der biomedizinischen Forschung, zu umgehen. Der Preisträger berichtete über seine Forschungen in labor&more 5/07. Die Redaktion freut sich darüber, ihn zu unseren Autoren zu zählen. Er entwickelte sozusagen im Alleingang das STED-Mikroskop. STED steht für stimulated emission depletion. Damit wird der physikalische Effekt beschrieben, der der Funktionsweise des Verfahrens zugrunde liegt (siehe Abb.1).
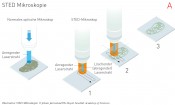
Abb.1 A Aufbau:1. In einem STED-Mikroskop wird die Fluoreszenz durch Abregung mit einem ringförmigen Strahl fokussiert. 2. Der Laserstrahl scannt die Probe. Da die Position bekannt ist, wo der Strahl die Probe trifft, kann die Information zur Bilderzeugung verwendet werden. 3. Das endgültig resultierende Bild (hier ein Mitochondrium) hat eine Auflösung, die sehr viel besser ist als 200 nm (Abbe-Limit). B: STED-Prinzip
Mithilfe der STED-Mikroskopie können heute schon Proteinverteilungen bis zu zehnmal schärfer als bisher dargestellt werden. Dies führt bereits jetzt zu wichtigen Erkenntnissen. So konnte die STED-Mikroskopie einzelne Bläschen mit Nervenbotenstoffen (synaptische Vesikel) auflösen und eine grundlegende Frage der Neurobiologie lösen (siehe Abb.2).
Abb.2 Die STED-Mikroskopie liefert hier zirka zehnmal schärfere Details (im Kreisausschnitt) von Filamentstrukturen einer Nervenzelle als ein herkömmliches Mikroskop (außen). © Bild: Donnert, Hell; Max-Planck-Institut für biophysikalische Chemie
Das fundamental Neue am Hell´schen Verfahren ist, dass seine Schärfe nicht mehr durch die Lichtwellenlänge begrenzt wird. Die erreichbare Auflösung ist nur noch eine Frage der technologischen Umsetzung. Da die Ausdehnung von Proteinkomplexen im Bereich von zehn bis 200 Nanometern liegt, hat das STED-Mikroskop das Potenzial, in die molekulare Skala des Lebens vorzudringen. Dies hat schon heute nachhaltige Konsequenzen, insbesondere in den Lebenswissenschaften und der Medizin: Man wird die Elementarprozesse des Lebens besser verstehen lernen und Krankheiten leichter auf die Spur kommen. Stefan Hell konnte eine ganze Familie von beugungsunbegrenzten Lichtmikroskopen definieren. Dazu ergänzte er Abbes Formel um einen entscheidenden Wurzelterm, der nun Auflösungen zulässt, die bis hin zu molekularen Dimensionen gehen können. Die bahnbrechenden Arbeiten von Stefan Hell wurden bereits am 23. November 2006 mit dem Zukunftspreis des Bundespräsidenten, einer der wohl wichtigsten Auszeichnungen für einen Wissenschaftler in Deutschland, gewürdigt. Die beiden anderen Preisträger, die US-Amerikaner Eric Betzig und William Moerner, verfolgten unabhängig voneinander ähnliche Ziele wie Stefan Hell – jedoch mit einer ganz anderen Methodik. Auch bei ihnen war die Basis der Entwicklungen die Fluoreszenzmikroskopie. Ihr Augenmerk war jedoch auf die Untersuchung einzelner Moleküle (Abb.3) gerichtet.
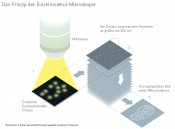
Abb.3 1. Ein schwacher Lichtpuls aktiviert einen Teil der fluoreszierenden Moleküle deren Abstand voneinander grösser ist als die Abbe´sche Diffraktionsgrenze von 200 nm. Sie leuchten bis zum Erlöschen. Danach wird das Experiment wiederholt und eine andere Untergruppe der Proteine wird zum leuchten gebracht. 2. Die aufgenommen Bild von vielen dieser Experimente werden mit den Methoden der Wahrscheinlichkeitstheorie bearbeitet, um sie schärfer werden zu lassen. 3. Dann werden alle Bilder überlagert, was schließlich dazu führt, dass individuelle Proteine erkannt und voneinander getrennt lokalisiert werden können
Bei den meisten chemischen Methoden, etwa zur Messung von Lichtabsorption und Fluoreszenz, werden Millionen von Molekülen simultan vermessen. Das Ergebnis ist dann ein Mittelwert über alle. William Moerner war weltweit der Erste, dem es 1989 gelang, die Lichtabsorption von einzelnen Molekülen zu vermessen. Acht Jahre später unternahm er den nächsten Schritt hin zur Einzelmolekül-Mikroskopie, aufbauend auf der mit dem Nobelpreis ausgezeichneten Untersuchung zum grünfluoreszierenden Protein (GFP; siehe labor&more 04/09). Moerner entdeckte, das die Fluoreszenz einer Varianten des GFP an- und ausgeschaltet werden konnte. Bei Anregung mit einer Wellenlänge von 488 nm begann das Protein zu fluoreszieren, aber nach einer Weile verblasste dieser Effekt – unabhängig davon, mit welcher Intensität es die Probe bestrahlte. Die Fluoreszenz war tot. Er wies jedoch nach, dass man sie wieder „beleben“ konnte, wenn man mit Licht der Wellenlange 405?nm bestrahlte. Moerner verbrachte die zu untersuchenden Proteine mit sehr geringer Konzentration in Gel ein, um sicherzustellen, dass der Abstand benachbarter Moleküle größer war als das Abbe-Limit von 200 nm. So konnte er einzelne Moleküle in einem normale Lichtmikroskop lokalisieren – kleine Lämpchen, die ein- und ausgeschaltet werden konnten. Die Ergebnisse wurden 1997 publiziert. Die Messungen von William Moerner lösten ein Problem, das von Eric Betzig bereit zwei Jahre zuvor formuliert hatte. Wie Stefan Hell war Eric Betzig besessen von der Idee, das Abbe-Limit zu durchbrechen und bessere Auflösung in optischen Mikroskopen zu erreichen. Angeregt durch die frühen Arbeiten von Moerner experimentierte er mit Methoden der Nahfeld-Mikroskopie und postulierte, dass die Auflösung bei Einzelmolekülexperimenten über das Abbe-Limit gebracht werden können, wenn unterschiedliche Moleküle mit unterschiedlicher Wellenlänge fluoreszieren würden. Die Realisierung scheiterte jedoch, da entsprechende Proteine von ihm nicht gefunden wurden. Er verließ die Wissenschaft und trat in die Firma seines Vaters ein. Irgendwann – Jahre später, 2005 – stolperte er über die Untersuchungen zu Proteinen, deren Fluoreszenz auf Kommando ein- und ausgeschaltet werden konnten. Er nahm die Forschungen wieder auf: Statt Moleküle mit unterschiedlicher Fluoreszenzwellenlänge müssten sich auch solche für seine theoretisch formulierten Konzepte eignen, die bei einer Wellenlänge, aber zu unterschiedlichen Zeiten fluoreszierten. Das war der Durchbruch. Durch Überlagerung von Einzelbildern entstand ein superaufgelöstes Bild einer Lysosom-Membran, 2006 in Science veröffentlicht (siehe Abb.4).
Abb.4 Das Bild in der Mitte zeigt eine Lysosommembran wie sie erstmals von Eric Betzig mit der Einzelmolekül-Mikroskopie aufgenommen und 2006 publiziert wurde. Zu sehen sind die Positionen von fluoreszierenden Proteinen, die an die Membran gekoppelt wurden. Links das gleiche Objekt mit konventioneller Mikroskopie aufgenommen, rechts ein Ausschnitt, der zeigt, dass die Auflösung wesentlich grösser ist als die Abbe-Grenze von 0,2 Mikrometern (Balken oben rechts). Quelle Science 313, 16422-1645
Die Methoden, die von Eric Betzig, Stefan Hell und William Moerner entwickelt wurden, haben heute zu einer Vielzahl von nanoskopischen Techniken überall in der Welt geführt. Die Laureaten haben ohne Zweifel die Grundlagen zu einer Kenntniserweiterung mit nachhaltiger Bedeutung für die Menschheit gelegt. Die Forschungen der drei Preisträger zeigt aber auch etwas anderes: Man muss das Unmögliche versuchen, um das Mögliche zu erreichen. Diese Denkweise spiegelt sich insbesondere in den Lebensläufen von Eric Betzig und und Stefan Hell wider und lässt sich wohl nicht besser fassen als durch ein Zitat von Stefan Hell (siehe Kasten). JB
Eric Betzig, US-amerikanischer Staatsbürger, wurde 1960 in Ann Arbor, MI, USA geboren. Er promovierte 1988 an der Cornell University, Ithaca, NY, USA. Zurzeit ist er Gruppenleiter am Janelia Research Campus, Howard Hughes Medical Institute (HHMI), Ashburn, VA, USA. Sein Arbeitsgebiet ist die physikalische Chemie. Bild: Matt Staley/HHMI
Stefan W. Hell, deutscher Staatsbürger, wurde 1962 in Arad, Rumänien geboren. Er promovierte 1990 an der Universität Heidelberg und ist heute Direktor am Max Planck Institut für Biophysikalische Chemie in Göttingen und Abteilungsleiter am Deutschen Krebsforschungsinstitut in Heidelberg. Sein Arbeitsgebiet ist die physikalische Chemie. Bild: © Jürgen Brickmann
William E. Moerner, US-amerikanischer Staatsbürger, wurde 1953 in Pleasanton, CA, USA geboren. Er promovierte 1982 an der Cornell University Ithaca, NY und ist heute Harry S. Mosher Professor für Chemie and Professor für angewandte Physik an der Stanford University, Stanford, CA, USA. Sein Arbeitsgebiet ist die physikalische Chemie. Bild: K. Lowder via Wikimedia Commons, CC-BY-SA-3.0
|
L&M 9 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |