|
Wissenschaft
 >
Photoaktive molekulare Schalter
>
Photoaktive molekulare Schalter
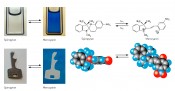
Photoaktive molekulare SchalterDie Funktionsweise von lichtgetriebenen ProzessenWenn wir sehen, gibt Licht den Anstoß, indem es einen molekularen Kippschalter im Auge umlegt. Licht und molekulare Schalter sind auch dann oft am Werk, wenn beispielsweise im Syntheselabor ein Katalysator aktiviert, in der Medizin ein Tumor bekämpft oder in der Sicherheitstechnik ein Code gespeichert wird. In all diesen Fällen bewirkt eine kleine Strukturänderung in einer geringen Anzahl von Schaltermolekülen die Änderung einer entscheidenden Eigenschaft des gesamten Materials: Es kann schlagartig seine Farbe, elektrische Leitfähigkeit, Härte, Löslichkeit, katalytische Aktivität oder eine andere Eigenschaft ändern. Damit ein Molekül tatsächlich die Bezeichnung Schalter verdient, muss es sehr viele Male ein- und ausgeschaltet werden können. Und wenn es ein lichtgesteuerter Schalter sein soll, dann muss er mit Licht ein- und auch ausgeschaltet, mindestens aber ein- oder ausgeschaltet werden können. Geht das überhaupt? Es geht, denn Moleküle sind sehr unterschiedlich und auch Licht ist nicht gleich Licht. Violettes Licht kann bei einem Material mit passendem molekularen Schalter eine Eigenschaft einschalten, grünes Licht schaltet sie wieder aus. Multiples Chamäleon und didaktisches Juwel Die Verbindung 6-Nitro-1,3,3-trimethylindolino-spiro-benzopyran, nachfolgend kurz als Spiropyran bezeichnet, ist seit 1950 literaturbekannt [1] und neuerdings im Chemikalienhandel erhältlich. Mit dieser Substanz lässt sich eine bunte Palette von Farben erzeugen, die ihre Ursachen in den Phänomenen der Photochromie, Solvatochromie und aggregationsinduzierten Lumineszenz haben. Das macht Spiropyran zu einem didaktischen Juwel für die experimentelle und konzeptionelle Vermittlung der Funktionsweise und strukturellen Grundlagen von molekularen Schaltern. Die Photochromie des Schalters Spiropyran/Merocyanin, d.h., der reversible Farbwechsel bei Bestrahlung mit Licht und bei Dunkelheit oder bei Bestrahlung mit Licht verschiedener Wellenlängen kann sowohl in Lösung als auch in einer Polymermatrix in einfachen und schnellen Handexperimenten demonstriert werden (Abb.1). Die photochemische Hinreaktion Spiropyran –> Merocyanin, die Blaufärbung, verläuft unabhängig von der Temperatur, bei der sie durchgeführt wird, innerhalb von 2s. Die thermische Rückreaktion, die Entfärbung, dauert in Lösung bei Raumtemperatur ca. 2min, in der Polymermatrix ca.1h. Während die Entfärbung bei höheren Temperaturen in beiden Fällen wesentlich schneller abläuft, kann die blaue Farbe sowohl in der Lösung als auch in der Polymermatrix bei Kühlfachtemperatur über mehrere Tage „eingefroren“ werden. Diese Befunde zeigen, dass die Reaktionsgeschwindigkeit einer rein photochemischen Reaktion nicht temperaturabhängig ist – ganz im Gegensatz zu thermischen Reaktionen.
Abb.1 In Toluollösung und in Polystyrol-Matrix wird farbloses Spiropyran mit Licht (1 = 450nm) in blaues Merocyanin geschaltet; dieses wird mit Licht (2 = 600 nm) oder thermisch zu Spiropyran zurückgeschaltet [2].
Die in Abbildung 1 dargestellten Farben, Formeln und Modelle sind ein Musterbeispiel für den Zusammenhang zwischen der von einer Substanz hervorgerufenen Farbe und der Struktur ihrer Moleküle. Im Spiropyran-Molekül ist die Bindungsdelokalisation am sp3-hybridisierten Kohlenstoffatom des Spiro-Zentrums unterbrochen, die Ebenen der beiden konjugierten Molekülteile sind hier um 90° gegeneinander verdrillt. Entsprechend absorbiert Spiropyran Licht nur schwach am kurzwelligen Rand des sichtbaren Spektrums und erscheint daher nahezu farblos. In dem insgesamt ebenen Merocyaninmolekül erstreckt sich der Chromophor über das ganze System, die zwitterionische Struktur verstärkt den Bindungsausgleich noch zusätzlich. Merocyanin absorbiert daher Licht im sichtbaren Bereich und erscheint in Toluollösung sowie Polystyrolmatrix blau (Abb.2). In zunehmend polaren Lösemitteln verschiebt sich das Absorptionsmaximum von Merocyanin nach kleineren Wellenlängen (hypsochrom), was auch eine deutliche Änderung der wahrgenommenen Farbe von Blau (max. = 600nm) über Pink (max. = 560nm) nach Rot (max. = 520nm) verursacht. Dieses Phänomen wird als negative Solvatochromie bezeichnet. Beim Merocyanin kann es schlüssig durch die Annahme erklärt werden, dass bei zunehmender Polarität der Lösemittelmoleküle das Merocyaninzwitterion durch energetische Absenkung seines HOMO stabilisiert wird. Da das LUMO energetisch gleich bleibt, müssen die für die elektronische Anregung absorbierbaren Photonen umso energiereicher sein, je polarer die Moleküle des Lösemittels sind.
Abb.2 Die Absorption von Merocyanin verschiebt sich bei steigender Polarität des Lösemittels hypsochrom (durchgezogene Kurven). Eine deutliche Fluoreszenz in Lösung tritt nur in polaren Lösemitteln auf (gepunktete Kurven), aber auch in einer unpolaren Polystyrolmatrix (gestrichelte Kurve). Die jeweils stärkste Absorption und Emission ist auf 1 normiert [3].
In Ethylenglykollösung ist Merocyanin gegenüber seinem Isomer Spiropyran energieärmer und damit stabiler. Es bleibt ohne Lichtbestrahlung langzeitig in Lösung und zeigt bei Bestrahlung mit UV-Licht ( = 366nm) eine deutliche Fluoreszenz, die im Vergleich zum Absorptionsmaximum um ca. 150nm bathochrom verschoben ist (Stokes-Verschiebung). Eine analoge Fluoreszenz ist in Acetonlösung nur minimal und in Toluol praktisch gar nicht zu beobachten (Abb.2). Es ist anzunehmen, dass Merocyaninzwitterionen in Ethylenglykollösung Aggregate bilden, in denen die intramolekularen Bewegungen (Vibrationen und Rotationen) stark eingeschränkt sind. Das hat eine aggregationsinduzierte Lumineszenz zur Folge, die in der Literatur an zahlreichen Beispielen dokumentiert ist [4]. Die Hypothese einer aggregationsinduzierten Emission wird auch durch die recht hübsche Beobachtung unterstützt, die in Abbildung 2 an der Fluoreszenz der „intelligenten Folie“ (Spiropyran in der Polystyrol-Matrix) zu sehen ist. Diese Emission erscheint erst, wenn Spiropyran durch Bestrahlung in Merocyanin überführt wurde und kommt zustande, weil die intramolekularen Bewegungen in den Merocyaninzwitterionen in der Polymermatrix stark eingeschränkt sind, ähnlich wie in den Aggregaten aus der Ethylenglykollösung. Die Nano-Umgebung der Merocyaninzwitterionen ist im Polystyrol ähnlich unpolar wie in Toluol – entsprechend ist die Stokes-Verschiebung der Emission in Polystyrol ca. 150nm bathochrom zur Absorption in Toluol. Wenn es also um die vielen Farben geht, die der molekulare Schalter Spiropyran/Merocyanin durch Absorption oder Emission von Licht erzeugt, kann man salopp sagen: „Die Nano-Umgebung macht’s.“ Kleiner Dreh mit großen Folgen Bei einer Z-E-(cis-trans)-Isomerisierung erfolgt formal nur „ein kleiner Dreh“ um die Achse einer Doppelbindung. Dabei ändert sich aber die Konfiguration des Eduktmoleküls, es bildet sich das Molekül einer neuen Substanz und der „kleine Dreh“ ist als chemische Reaktion einzustufen. Auf der stofflichen Ebene der Phänomene bewirkt eine Z-E-Isomerisierung besonders dann große Folgen, wenn sie an einer Doppelbindung erfolgt, die als Struktureinheit in einem größeren Molekül enthalten ist. Die Konfigurationsänderung an der N=N=Doppelbindung in den modifizierten Kronenethern aus Abbildung 3 bewirkt auch eine Konformationsänderung in den Molekülen. Dadurch werden diese als Wirte für Komplexbildung mit Metall-Ionen befähigt oder von dieser Eigenschaft ausgeschlossen. So kann beispielsweise das Z-Azophan mit n=2 einen stabilen Wirt-Gast-Komplex mit Kaliumionen bilden, der beim Zurückschalten zum E-Azophan zerfällt.
Abb.3 Kronenether-Moleküle, die eine Azobenzol-Einheit enthalten, lassen sich mit Licht der Wellenlängen 1 = 330–380 nm von E nach Z und mit 2 > 460 nm wieder zurück von Z nach E schalten [5, 6]. Die Reaktionswege der beiden photochemischen Isomerisierungen verlaufen über den elektronisch angeregten Zustand entlang der blauen bzw. grünen Pfeile [2].
Molekulare Schalter – Nano-Roboter für viele Funktionen Der oben diskutierte Schalter E-/Z-Azophan kann zum Durchschleusen von Kaliumionen durch eine Doppellipidmembran genutzt werden, weil der Wirt-Gast-Komplex aufgrund seiner Kronenetherperipherie lipophil ist [5, 6]. Man könnte also von einem molekularen „Trojanischen Pferd“ sprechen. Stefan Hecht et al. haben über einen thermischen Katalysator berichtet, der wie ein molekularer Roboter arbeitet, weil er mit Licht wechselweise aktiv und inaktiv geschaltet werden kann [7]. Durch Bestrahlung mit UV-Licht ( = 365nm) erzeugt man an einer Azo-Gruppe eine E-Z Isomerisierung, durch die im gleichen Molekül ein katalytisch aktives, nucleophiles Zentrum freigesetzt wird. Durch eine ebenfalls photochemische Z-E-Rückisomerisierung ( > 400nm) an der Azo-Gruppe wird das nucleophile Zentrum wieder maskiert und der Katalysator inaktiv geschaltet. Auf Z-E-Isomerisierungen basieren auch die von der Arbeitsgruppe um Ben Feringa synthetisierten und beschriebenen molekularen Motoren, die als lichtgetriebene rotierende Räder und Rührstäbchen Highlights der aktuellen Grundlagenforschung auf dem Gebiet der molekularen Schalter darstellen [8, 9].
Molekülmodell eines Z-Azophans (Kronenether mit einer Azobenzoleinheit in Z-Konfiguration).
Literatur Bild: ©istockphoto.com|Stephan Zabel |
L&M 9 / 2015
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |