|
Forscher
>
PD Dr. Steffen Rupp
>
Neue Verfahren für die Ligninmodifikation am Beispiel der Natur
Neue Verfahren für die Ligninmodifikation am Beispiel der NaturWohin mit dem Lignin?
Der Holzbestandteil Lignin ist das zweithäufigste Biopolymer auf der Erde. Es wurde lange Zeit kaum stofflich genutzt und als Abfallstoff der Papier- Ein Blick in die Natur zeigt, dass einige Pilze und Bakterien über die Fähigkeit verfügen, Lignin abzubauen und zu verstoffwechseln. Das Verständnis dieser natürlichen Mechanismen könnte helfen, neue Prozesse zur maßgeschneiderten Modifikation von Lignin zu entwickeln und bisherige Verfahren durch biotechnologische Verfahren zu ergänzen. Lignin – zweithäufigstes Biopolymer der Welt Verholzte Biomasse besteht zum Großteil aus dem Verbundstoff Lignozellulose. Dieser setzt sich aus den Komponenten Zellulose, Hemizellulose und Lignin zusammen. Zellulose ist ein unverzweigtes Polymer aus Glukosemonomeren, das vor allem in kristalliner Form aufritt und in Fasern, so genannten Fibrillen, angeordnet ist. Hemizellulose dagegen besteht aus verschiedenen Fünffach- und Sechsfachzuckern, die ein verzweigtes Polymer bilden, das die Zellulosefibrillen umgibt. Bei der Verholzung von Pflanzen werden die aromatischen Ligninbausteine Coniferyl- Cumaryl- und Sinapylalkohol untereinander radikalisch zu dem dreidimensionalen Polymer Lignin verknüpft, das sich an die Hemizellulosematrix anlagert [1] (Abb.1). Diese Struktur sorgt zum einen für die nötige Stabilität und Beständigkeit, die höheren Pflanzen das Höhenwachstum und den Transport von Wasser in Leitsystemen erlaubt, zum anderen stellt sie einen Schutz vor enzymatischen und mechanischen Angriffen durch Fraßfeinde dar [2, 3]. Hemizellulose und Zellulose können von vielen Organismen durch enzymatische Hydrolyse der glykosidischen Bindungen zu ihren Zuckermonomeren abgebaut und verwertet werden. Lignin ist, bedingt durch die ungerichtete radikalische Verknüpfung der Aromaten, ein sehr komplexes dreidimensionales Molekül mit chemisch resistenten und stereochemisch diversen Ether- und C-C-Bindungen [4]. Der Abbau von Lignin stellt daher eine große Herausforderung dar, dem nur wenige Organismen gewachsen sind.
Abb.1 Schematischer Aufbau von Lignozellulose (A) und Lignin (B) Bild: Fraunhofer IGB
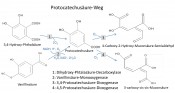
Ligninabbau durch Pilze und Bakterien Die Entwicklung des Ligninabbaus konnte auf das späte Karbonzeitalter datiert werden und wird mit dem starken Rückgang der Kohleablagerung in Zusammenhang gebracht [5]. Insbesondere Weißfäulepilze sind dafür bekannt, Lignin effektiv abbauen zu können. Sie sekretieren einen Cocktail an Enzymen, die das Ligninmolekül im Zusammenspiel depolymerisieren. Auschlaggebend sind hierbei Oxidoreduktasen, die das Ligninmolekül über radikalische Reaktionen angreifen. Die Ligninperoxidasen haben ein hohes Redoxpotential und oxidieren phenolische und nichtphenolische Ligninkomponenten. Mangan-Peroxidasen oxidieren Mn(II) zu Mn(III), das wiederum in das Ligninmolekül diffundiert und phenolische Strukturen oxidiert. Des Weiteren verfügen einige Weißfäulepilze über Versatile-Peroxidasen, die sowohl Mn(II) und als auch direkt nicht-phenolische Aromate oxidieren. Weiterhin spielen Laccasen beim Abbau von Lignin eine Rolle. Diese kupferhaltigen Oxidasen benötigen im Gegensatz zu den genannten Peroxidasen nur O2 als Elektronenakzeptor. Jedoch können Laccasen nicht-phenolische Strukturen nur über Mediatormoleküle oxidieren [6]. Kürzlich wurde eine weitere Klasse von Peroxidasen, die so genannten Dyp-type-Peroxidasen, beschrieben, die wahrscheinlich ebenfalls am Ligninabbau beteiligt sind. Die Dyp-type-Peroxidasen kommen in Pilzen vor, sind jedoch im Gegensatz zu den anderen ligninolytischen Peroxidasen auch in Bakterien zu finden [7]. Neben den Weißfäulepilzen sind einige Bakterienstämme innerhalb der Aktinobakterien und der alpha-und gamma-Proteobakterien beschrieben, die Lignin abbauen können [8]. Die Dyp-type-Peroxidasen könnten ähnlich wie bei den Pilzen auch beim bakteriellen Ligninabbau eine Rolle spielen. Ein weiterer Gegenstand der Erforschung des Ligninstoffkreislaufs ist die Mineralisierung von Ligninabbauprodukten. Es sind einige Bakterienstämme bekannt, die Ligninabbauprodukte als Kohlenstoffquelle nutzen können. Diese Bakterien scheinen über eine Vielzahl von Enzymen zu verfügen, die in der Zelle niedermolekulare Ligninderivate weiter abbauen. Über Reaktionen wie die Demethylierung, Ringöffnung in Aromaten und Spaltung von Etherbindungen werden verschiedene Ligninderivate modifiziert, gespalten und letztlich als Pyruvat und Oxalacetat dem Zellstoffwechsel zugeführt [9]. Die Enzyme sind bisher nur zu einem geringen Anteil charakterisiert und viele Enzyme noch nicht identifiziert.
Abb.2 Vorhergesagter Protokatechusäure-Stoffwechselweg in Pseudonocardia sp. Bild: Fraunhofer IGB
Warum den Ligninabbau erforschen? Fossile Rohstoffe müssen langfristig nicht nur als Energieträger, sondern auch im Bereich der stofflichen Nutzung ersetzt werden. Das Konzept der Lignozellulose-Bioraffinerie umfasst den Aufschluss und die ganzheitliche stoffliche Nutzung des erneuerbaren Rohstoffes Lignozelluose. Die Zucker aus der Hemizellulose und Zellulose können zur chemischen und biotechnologischen Herstellung verschiedenster Chemikalien eingesetzt werden. Lignin wird bereits in einigen Anwendungen eingesetzt, z.B. als Betonadditiv. Lignin bietet jedoch viele weitere Möglichkeiten wie beispielsweise die Herstellung verschiedenster Kunststoffe auf Aromatenbasis oder die direkte Umsetzung zu aromatischen Chemikalien wie z.B. Phenol. In dem von BMEL und der FNR geförderten Verbundvorhaben „Lignoplast“ (Funktionalisierte Ligninspaltprodukte als Synthesebausteine für die Herstellung von Klebstoffen, Lacken, Polyurethanen und Epoxyden, FKZ:22024512) wird gemeinsam mit Industriepartnern der Einsatz von Lignin als Komponente in Polyurethanen und Kunstharzen untersucht. Dafür muss das Ligninmolekül zu kleineren funktionellen Bruchstücken abgebaut werden. Durch physikalische und chemische Prozesse lassen sich beispielsweise ß-Etherbindungen im Lignin leicht spalten, die C-C-Bindungen sowie Methoxylgruppen sind jedoch deutlich stabiler [3]. Biokatalysatoren könnten hier zur weiteren Modifizierung und Funktionalisierung von Ligninderivaten eingesetzt werden. Peroxidasen oxidieren aromatische Strukturen, wobei die Spaltung von C-C-Bindungen und die Entstehung neuer funktioneller Gruppen auftritt [1]. Des Weiteren können über spezifischere Enzyme wie beispielsweise Demethylasen neue funktionelle Gruppen erzeugt werden, die als Anknüpfungspunkt für Polymerisationsreaktionen dienen. Somit können gezielt die gewünschten Struktureigenschaften von Ligninabbauprodukten geschaffen werden. Verfahren mit neuen Biokatalysatoren können an chemische und physikalische Prozesse anknüpfen und zu einer Erweiterung des Produktspektrums für Lignin als Rohstoff beitragen. Entdeckung neuer ligninmodifizierender Enzyme Neben der Kultivierung von Weißfäulepilzen und der Optimierung der Ausbeute von ligninolytischen Enzymen werden am Fraunhofer IGB auch neue Enzyme zur Ligninmodifizierung gesucht. Dabei werden vor allem ligninolytische Bakterien betrachtet, da bakterielle Enzyme im Vergleich zu pilzlichen Enzymen einfacher in etablierten Wirtsorganismen wie E. coli hergestellt werden können. Da der bakterielle Ligninabbaumechanismus und die daran beteiligten Enzyme nur wenig erforscht sind, bieten sie ein großes Potenzial für die Entdeckung und Untersuchung neuer ligninmodifizierender Enzyme. Eine Vielzahl verschiedener ligninolytischer Bakterienstämme wurde zunächst kultiviert und die oxidative Enzymaktivität im Überstand gemessen. Die beiden Stämme Pseudonocardia sp. und Streptomyces sp. wurden hinsichtlich ihres genetischen Hintergrundes näher untersucht. Die Genome wurden sequenziert, assembliert, die offenen Leserahmen identifiziert und in Aminosäuresequenzen übersetzt. Über einen Sequenzabgleich mit Datenbanken über BlastP wurden viele potenzielle Enzyme identifiziert, darunter drei Dyp-type-Peroxidasen und zahlreiche Enzyme des intrazellulären Aromatenstoffwechsels wie Demethylasen, Dioxygenasen und Hydroxylasen. Diese vorhergesagten Enzyme können Stoffwechselwegen zugeordnet werden. Beispielsweise wurden in Pseudonocardia sp. mehrere Enzyme des Protokatechusäure-Abbauweges entdeckt (Abb.2). Die vorhergesagte Funktion der Vanillat-Monooxygenase stellt hier eine interessante Reaktion dar, da durch eine Demethylierung eine neue funktionelle Gruppe entsteht. Die neu identifizierten Enzyme werden in dem Wirtsstamm E. coli exprimiert, aufgereinigt und ihre katalytischen Eigenschaften im Hinblick auf die Umsetzung von Lignin und Ligninderivaten untersucht. Es werden dadurch zum einen neue Erkenntnisse über den Vorgang des Ligninabbaus in Bakterien gewonnen und zum anderen sollen geeignete Enzyme zur Ligninmodifizierung gefunden und für industrielle Anwendungen bereitgestellt werden. Literatur
[1] Kirk, T.K. & Farrell, R. L. (1987) Annu. Rev. Microbiol. 41, 465–501 Bild: © istockphoto.com| Antrey |
L&M 7 / 2014
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |