|
Forscher
>
Dr. Roman Truckenmüller
>
Eine neuartige 3D-Zellkulturplattform
Eine neuartige 3D-ZellkulturplattformMikrokavitätenarrays für die flexible Herstellung einer Vielzahl homogener 3D-Aggregate
Die Geschichte der Zellkulturen stützt sich seit jeher auf Systeme, die eine Kultivierung auf planaren Oberflächen und damit in nur zwei Dimensionen (2D) zulassen. Zu diesen Systemen gehören Petri schalen, Kulturflaschen und deren Derivate wie Multiwell-Platten. Die über hundertjährige Erfolgsgeschichte der 2D-Systeme ist auf die einfache Handhabbarkeit,
Häufig kommen dabei einfachste Formen der 3D-Kultur, sogenannte Sphäroide, zum Einsatz. Sphäroide werden in der Regel durch Aggregation von Einzelzellen im sogenannten Hanging- Drop-Verfahren hergestellt. Dazu wird ein geringes Volumen Nährmedium mit einer Einzelzellsuspension z. B. an den Deckel einer Petrischale „gehängt“ und zwei bis drei Tage inkubiert.
Abb.1 Folienbasierte Mikrokavitäten zur 3DKultur von Zellen. Maßstabsbalken entspricht 300 ?m. x1, y1 usw. stellen Mikrokavitätenpositionen dar.
Abb.2 Mikrotiterplatten mit Mikrokavitäten-Array-Folienboden. Oben: 10 Mikrokavitäten pro Well, unten: 169 Mikrokavitäten pro Well einer Platte mit denen 960 bzw. 16.224 dreidimensionale Zellaggregate simultan erzeugt/beobachtet werden können.
3D einmal anders und doch sehr vertraut Wir sind einen eigenen Weg zur Herstellung von 3D-Kulturen gegangen, um einige der Nachteile, die mit den oben genannten Verfahren assoziiert sein können, zu umgehen. Wir haben ein Verfahren entwickelt, mit dem sich dünne Polymerfolien mithilfe des sogenannten Mikrothermoformens strukturieren lassen. Das Thermoformen ist zwar schon seit Langem aus dem makroskopischen Bereich, z. B. zur Herstellung von Verpackungen wie beispielsweise Tablettenblistern, bekannt, bislang konnten aber keine Strukturen im Mikrometermaßstab hergestellt werden [1–3]. Das von uns entwickelte und patentierte sogenannte SMART-Verfahren (Surface Modification And Replication by Thermoforming) ist eine Prozessfolge, die aus einem Vorprozess, dem eigentlichen Thermoformen der Folie als Hauptprozess, und teilweise einem nachgelagerten Prozess besteht. Im Vorprozess können Folien z. B. lokal so modifiziert werden, dass die Polymeroberfläche dort für Zellen besonders attraktiv oder auch besonders unattraktiv wirkt. Unser Verfahren bietet den großen Vorteil, dass durch die vergleichsweise kalte Verarbeitung der Folie und den dadurch bedingten durchgehenden strukturellen Zusammenhalt der Folie die Modifikationen erhalten bleiben. Dadurch lassen sich auch solche Bereiche der Folienstrukturen modifizieren, die in einer bereits geformten Folie für eine Modifikation nicht oder nicht mehr kontrolliert zugängig wären. Dies trifft z.B. auf Hinterschnitte in 3D-Geometrien zu, die beispielsweise für den Fall von Oberflächenmodifikationen mit UV-Licht nicht belichtet werden könnten. Dadurch ergeben sich Möglichkeiten der Erzeugung aller erdenklichen Muster, um beispielsweise gezielt Zelladhäsion in Mikrostrukturen zu kontrollieren. Der zentrale Schritt der SMART-Technologie, das Mikrothermoformen, führt zu einer Erzeugung sehr dünnwandiger Mikrokavitäten, deren Abmessungen typischerweise in Größenordnungen liegen, in denen biologische Strukturen von Natur aus angelegt sind. So beträgt z.B. die maximale Distanz zwischen zwei Blutkapillaren in einem typischen tierischen Gewebe bis zu 300 ?m, d.h., die Zellen zwischen diesen Kapillaren werden gerade noch durch Diffusion versorgt. Die Mikrokavitätendurchmesser und deren Tiefe sind diesen natürlichen Gegebenheiten nachempfunden (Abb. 1).
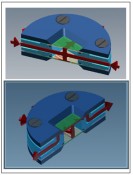
Abb.3 Bioreaktor für die Aufnahme von Mikrokavitäten-Arrays zur Durchführung von Versuchen mit aktivem Mediumfluss.
Abb.4 Perfusion (oben) und Superfusion (unten) in mit Mikrokavitäten-Array bestücktem Bioreaktor. Rot: Mediumfluss.
Flexibilität zahlt sich aus Grundsätzlich ist das Verfahren sehr flexibel, sodass Mikrokavitäten in allen möglichen Geometrien und Größen, von wenigen Mikrometern bis hin zu Zentimetern geformt werden können. Die Mikrokavitäten können zu Arrays angeordnet und als solche in viele Zellkultur-Standardformate integriert werden, wie z.B. in Petrischalen und Mikrotiterplatten (Abb. 2). Der SMART Prozess kann auch als ein Prozess zum Einbringen von Poren in die dreidimensional geformten Folien angelegt sein. Poröse Mikrokavitäten Arrays eignen sich z.B. für die Realisierung von 3D-Boyden-Chamber Assays, da die Folien als Böden in klassischen Filter-Inserts für Multiwell- und Mikrotiterplatten eingesetzt werden können. Poröse Kavitäten bieten darüber hinaus die Möglichkeit, die in den Kavitäten kultivierten 3D-Aggregate aktiv mit Medium zu versorgen. Dies kann dadurch erreicht werden, dass die Mikrokavitäten-Arrays in eigens dafür entwickelte Bioreaktoren von der Größe einer 6-cm-Petrischale integriert werden (Abb. 3). Durch das geschlossene, reperfundierte System, das neben dem Bioreaktor aus einer Kassettenpumpe und einer Mediumvorlage besteht, welche wiederum über eine Gasmischanlage definiert mit Gasen beaufschlagt werden kann, kann eine Vielzahl von Experimentkonfigurationen verwirklicht werden. So kann das Medium z.B. durch die Poren der Folien und damit durch jede einzelne Mikrokavität gepumpt werden, um die Zellen optimal mit Nährstoffen und Sauerstoff zu versorgen. Um gezielt Gradienten zu erzeugen, kann der Medienfluss auch so gewählt werden, dass er parallel zur Mikrokavitätenfläche gerichtet ist. Die Zellen werden dann in der Tiefe der Kavitäten nur durch Diffusion versorgt, weshalb die beiden Versorgungsmodi von uns als Perfusion bzw. Superfusion bezeichnet werden (Abb. 4). Darüber hinaus lassen sich auch zwei verschiedene Medien auf der Ober- und Unterseite des Mikrokavitäten Arrays einsetzen, um so gezielt Gradienten über dem Gewebe zu erzeugen. Seine Eignung für Versuche mit unterschiedlichsten Zellen hat das System bereits in zahlreichen Publikationen bewiesen.
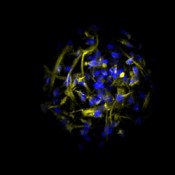
Abb.5 Mesenchymale Stammzellen aus Knochenmark in Co-Kultur mit Zellen der mononukleären Fraktion aus Humanblut im Mikrokavitäten- Array. Blau: Zellkerne (Hoechst 33342), gelb: Vimentin (Alexa Fluor 546).
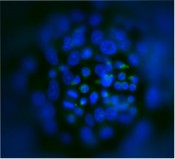
Abb.6 Co-Kultur von hämatopoetischen Stammzellen mit Hepatomzellen (Hep G2) in Mikrokavitäten-Array-Platten zur Modellierung der fötalen, hämatopoetischen Nische in der Leber. Kernfärbung: Hoechst 33342, grün: CD34 (Alexa Fluor 488).
Künstliche Stammzellnischen Seit einigen Jahren liegt ein Schwerpunkt der Anwendungsentwicklungen der Mikrokavitäten- Arrays auf deren Einsatz als Stammzellplattform. Die physiologischen Größenordnungen sollen dabei derart genutzt werden, dass Mikrokavitäten als artifizielle Stammzellnischen fungieren können. Hintergrund dieser Forschungen ist das Anliegen, Patienten optimal in ihrer Therapie zu unterstützen. Insbesondere bei verschiedenen Leukämieerkrankungen können Stammzellen einen wichtigen Beitrag zur Genesung nach einer aggressiven Therapie mit Zytostatika und/oder Bestrahlung darstellen, da durch diese Therapieverfahren das Knochenmark und damit die Stammzellpools der Patienten in Mitleidenschaft gezogen werden können. Damit besteht ein hohes Infektionsrisiko nach Therapieende, da nicht schnell genug Zellen der Immunabwehr neu gebildet werden. Dem kann begegnet werden, indem vor Therapiebeginn patienteneigene Blutstammzellen (HSC) isoliert werden. Bislang war es jedoch außerordentlich schwierig, die isolierten Blutstammzellen in vitro in ihrem Stammzellcharakter zu konservieren, sodass nach Therapieende die vorher isolierten Stammzellen bereits vollständig differenziert waren und somit nicht zur Auffüllung der Stammzellpools herangezogen werden konnten. Mit der Kultivierung in Mikrokavitäten- Arrays sind wir einer Lösung dieses Problems deutlich näher gekommen, da wir in einer Kooperation mit der Universitätsklinik Heidelberg zeigen konnten, dass HSC in Co-Kultur mit mesenchymalen Stammzellen über einen Zeitraum von zwei bis drei Wochen zumindest teilweise in ihrem Stammzellcharakter erhalten werden können, wenn sie unter den richtigen Bedingungen in aktiv durchströmten Mikrokavitäten-Arrays (Abb. 3) kultiviert werden [4]. Passive Systeme Neben den aktiv durchströmten Systemen, die eher Grundlagenforschungszwecken dienen, kommen auch passive Systeme zum Einsatz, z.B. auf Mikrotiterplattenbasis. Die in die Mikrotiterplatten integrierten Mikrokavitäten-Arrays eignen sich ideal zu Screening-Zwecken im Bereich von Toxizitäts- und Wirkstofftests in entsprechenden High-Throughput-/High-Content-Screening-Kampagnen. Durch die definierte Position der Mikrokavitäten kann deutlich schneller und damit kostengünstiger mikroskopiert werden. Des Weiteren ist die Anzahl der Mikrokavitäten in den Wells einer Mikrotiterplatte variabel. Somit lassen sich auch mit eingeschränkt verfügbaren (primären) Zellen 3D-Aggregate der erforderlichen Größe und Anzahl herstellen (Abb. 5, 6). Die Zellen werden mit Standardpipettierhilfen oder Robotern in die Mikrokavitäten gebracht. Dort aggregieren sie in kurzer Zeit zu dreidimensionalen Aggregaten, ohne jedoch dabei zusätzliche Gerüststrukturen zu benötigen. Dabei können die Oberflächen als nicht-adhärent oder adhärent ausgeführt werden, sodass die darin kultivierten Zellen an den Polymeroberflächen nicht haften bzw. anhaften können. Differenzierte, nicht proliferierende Zellen können so über mehrere Wochen in den Mikrokavitäten-Arrays kultiviert werden. Für eine Downstream-Analytik lassen sich die Zellen aus den Mikrokavitäten mit gängigen Techniken zurückgewinnen, sodass sowohl intakte Zellen als auch Zellinhaltsstoffe wie DNA, RNA oder Proteine isoliert werden können. Ausblick Mit den Mikrokavitäten-Arrays steht eine neue Methode zur Herstellung von 3D-Aggregaten zur Verfügung, die eine schnelle Herstellung einer Vielzahl homogener 3D-Aggregate ermöglicht. Die so erzeugten Aggregate lassen sich sowohl für die Grundlagenforschung als auch industrielle Anwendungen wie das High-Throughput-/High-Content-Screening verwenden. Die Kombination mit Mikrotiterplatten macht das System nahtlos kompatibel zu gängiger Laborinfrastruktur in Forschung und Industrie. Ferner lassen sich für Downstream-Applikationen die Zellen oder Zellinhaltsstoffe aus den Mikrokavitäten zurückgewinnen.
Literatur Danksagung
Wir bedanken uns bei der Karlsruhe Nano Micro Facility (KNMF, www.kit.edu/ |
L&M 1 / 2016
Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |