|
Forscher
>
PD Dr. Günter Fritz
>
Der Choleraerreger setzt auf alternative Energie
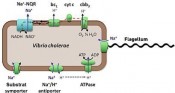
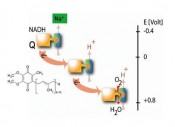
Der Choleraerreger setzt auf alternative EnergieÜberleben im DarmAlle Lebewesen sind darauf angewiesen, ihre Zellhüllen durch einen elektrochemischen Protonen-Gradienten aufzuladen. Diese Energetisierungen werden ermöglicht durch gezielte Umwandlungen von Lichtenergie innerhalb der Photosynthese, oder von chemischer Energie innerhalb der Atmungskette. Der Erreger der Cholera, Vibrio cholerae, verfügt jedoch noch über eine zusätzliche Natriumionen-Batterie: Seine einzigartige Na+-Redoxpumpe erzeugt einen elektrochemischen Natriumionengradienten und garantiert so das Überleben dieses humanpathogenen Bakteriums auch unter harschen Umweltbedingungen. Natriumionenpumpen sind in pathogenen Bakterien weitverbreitet Die wichtigsten „Energieverbraucher“ in der Zellhülle sind Prozesse, bei denen der elektrochemische Protonengradient zur Synthese der energiereichen Substanz ATP, zur Aufnahme von Substraten, oder zur Fortbewegung genutzt wird. Vibrio cholerae ist in der Lage, seine Zellhülle, genauer seine innere Zellmembran, durch einen elektrochemischen Natriumionengradienten aufzuladen. Entscheidend für den Aufbau dieses Na+-Gradienten ist die Na+-transportierende NADH:Chinon Oxidoreduktase (Na+-NQR), eine Na+-Pumpe. Dieses zelluläre Kraftwerk findet sich nicht nur in Vibrio cholerae und seinen näheren Verwandten, sondern auch in vielen anderen pathogenen Mikroorganismen, wie aus den vielen bereits sequenzierten mikrobiellen Genomen geschlossen werden kann. Kosten und Nutzen der Na+-Batterie von Vibrio cholerae Warum betreibt Vibrio cholerae den Aufwand, ein alternatives, Na+-abhängiges Energiesystem zu unterhalten? Auf den elektrochemischen Protonengradienten kann, begründet durch die strikte Abhängigkeit der ATP-Synthese vom elektrochemischen Protonenpotenzial (Abb. 1), nicht verzichtet werden. Eine primäre, also direkt durch eine chemische Reaktion angetriebene Na+-Pumpe wie die Na+-NQR, ist ein in der Produktion „teurer“ Enzymkomplex, der aus sechs Untereinheiten und vielen verschiedenen Kofaktoren aufgebaut ist (Abb. 2). Das Produkt der Na+-NQR, der Na+-Gradient, könnte prinzipiell auch durch die sekundären Na+ / H+-Antiporter geliefert werden. Sekundär heißen diese Antiporter, weil sie auf Kosten des elektrochemischen Protonenpotenzials den Einstrom von Protonen in die Zelle mit dem Ausstoß von Na+ koppeln. Nicht so die Na+-NQR: Als primäre Na+-Pumpe benötigtsie nur die Substrate NADH und Chinon (Q), die in einer exergonen Redoxreaktion zu NAD+ und Chinol (QH2) umgesetzt werden: NADH + Q (+ xNa+ innen) - NAD+ + QH2 (+ xNa+ außen) Diese Reaktion „entkoppelt“ also die Erzeugung eines Natriumionen- Gradienten von dem elektrochemischen Protonenpotenzial: Vibrio cholerae verfügt über die Energie aus der Na+-Batterie, auch wenn sein Protonengradient beispielsweise durch Immunzellen des befallenen Wirts zerstört wurde. Die Stöchiometrie x der Na+- NQR, also die Anzahl der pro umgewandeltem NADH transportierten Na+-Ionen, ist wahrscheinlich maximal 2 [1]. Diese exergone, Energie freisetzende Reaktion ist gekoppelt an den endergonen, also Energie verbrauchenden Transport von Na+ über die Membran. Solange die Substrate in ausreichender Menge zur Verfügung stehen, kann die Pumpe arbeiten. Dies ist gewährleistet bei ausreichender Zufuhr von organischen Verbindungen wie Zucker oder Aminosäuren, die den NADH-Pool in der Bakterienzelle aufrecht erhalten, und von molekularem Sauerstoff, der als ultimativer Akzeptor für Elektronen im System benötigtwird (Abb. 3). Mittels zwischengeschalteter Atmungskettenkomplexe sorgt O2 dafür, dass Chinol immer wieder zu Chinon oxidiert wird und der Na+-NQR zur Verfügung steht. Molekularer Sauerstoff ist mit seinem Standardredoxpotenzial von + 0,8 V ein besonders guter Elektronenakzeptor. Bei der Oxidation von NADH mit einem Standardredoxpotenzial von – 0,34 V steht der gesamten Atmungskette von Vibrio cholerae eine Redoxpotenzialdifferenz (1,14 V) zur Verfügung, die mit der Energieversorgung in einem Mitochondrium eines Eukaryonten gleichzieht. Die Na+-NQR ist jedoch mit der mitochondriellen NADH: Chinon Oxidoreduktase nicht verwandt und leistet ihren Energiebeitrag ausschließlich in Form eines Na+- Gradienten. Besonders wichtig wird die Na+-NQR bei Wachstum des Choleraerregers in alkalischem Milieu, und das ist nicht verwunderlich: Ist die äußere Protonenkonzentration niedriger als die Protonenkonzentration im Cytoplasma von Vibrio cholerae, vermindert sich die Energie, die die Protonenbatterie zur Verfügung stellen kann. Dann garantiert die Na+-NQR eine gleichbleibende Energieversorgung der Zelle. Die Na+-Pumpe des Choleraerregers ermöglicht dessen Überleben im Darm
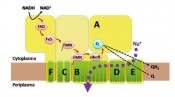
Ist die Na+-Pumpe von Vibrio cholerae essenziell für die Persistenz dieses pathogenen Mikroorganismus im menschlichen Wirt? In einer am Mausmodell durchgeführten Studie konnte gezeigt werden, dass V. cholerae-Stämme, denen die Na+-Pumpefehlt, den Dünndarm schlechter besiedeln können als Stämme, die die Na+-Pumpe besitzen. Weiterhin zeigten diese Mutanten eine geringere Überlebensfähigkeit unter sauren Bedingungen, wie sie nach der oralen Aufnahme des Erregers bei der Passagedurch den Magen mit seinem sauren Milieu zu erwarten sind [2]. Dies war ein unerwartetes Ergebnis, denn V. choleraeverfügt über viele verschiedene andere Systeme, mit denen die H+- und Na+-Konzentrationsgradienten an der Zellmembran eingestellt und ausgeglichen werden können( Abb. 1). Die dreidimensionale Struktur der Na+-Pumpe Nur eine hochauflösende, dreidimensionale Struktur der Na+-transportierenden NADH: Chinon Oxidoreduktase wird es erlauben, den Prozess des Transports der Natriumionen über die Membran von Vibrio cholerae im Detail beschreiben zu können. Auf dem Weg dahin sind Strukturermittlungen bei geringerer Auflösung unabdingbar. In einer Kombination von röntgenkristallographischen und elektronenmikro- skopischen Methoden gelang die Aufklärung der Struktur der NADH-getriebenen Na+-Pumpe von Vibrio cholerae bei einer Auflösung von 16 Å [3]. Die Struktur offenbart einen assymetrischen Enzymkomplex, der eine zentrale Region mit geringerer Elektronendichte aufweist, die dem in der Zellmembran integrierten Teil des Komplexes zuzuordnen ist. Damit ist die Darstellung des Komplexes in einer physiologisch relevanten Orientierung gelungen und kann als Wegweiser für verbesserte Strukturen der Na+-Pumpe dienen. Bakterielle Enzyme der Energieumwandlung als Zielproteine für neue Antibiotika Die Entdeckung eines antibakteriellen Wirkstoffs, der den Erreger der Tuberkulose( Mycobacterium tuberculosis) selektiv inhibiert, ist ein Durchbruch in der Bekämpfungder Tuberkulose, einer Lungeninfektionskrankheit, die weltweit wieder auf dem Vormarsch ist. Was ist daran so ungewöhnlich? Der Wirkstoff inaktiviert ein zentrales Enzym des Energiestoffwechsels, die ATPSynthase [4]. Sie ist hochkonserviert und in allen Lebensformen anzutreffen, und es schien unwahrscheinlich, dass eine Substanz die bakterielle ATP-Synthase, nicht jedoch das menschliche Enzym, hemmen könnte. Und doch zeigte der neue Wirkstoff im Menschen gute Verträglichkeit [4]. Diese Studien zeigten auf, dass eine ganz neue Klasse von bakteriellen Proteinen als Angriffsort zur Bekämpfung bakterieller Infektionen berücksichtigt werden sollte: Die Enzyme des zentralen Metabolismus und der Energieversorgung der Zelle. Die Na+-NQR ist ein solches Enzym. Sie ist, anders als die ATP-Synthase, im Menschen nicht vorhanden, was sie als Zielprotein für neue Antibiotika, die den zentralen Katabolismus des Pathogenen inaktivieren sollen, umso attraktiver macht. Literatur
[1] Tao, M., Casutt, M.S., Fritz, G. & Steuber, J. (2008) Biochim. Biophys. Acta 1777, 696-702. Foto: © Prof. Dr. Julia Steuber / PD Dr. Günter Fritz |
L&M 8 / 2012
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Die Autoren:Weitere Artikel online lesenNewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |