|
Biosensoren auf der Basis von Mikroelektroden-Arrays
Biosensoren auf der Basis von Mikroelektroden-Arrays
Leben auf dem Mikrochip
Egal, ob Maus, Affe oder Mensch: Komplexe Organismen sind aus einer Vielzahl funktional differenzierter Zellen aufgebaut, deren Zusammenleben und Überleben vom Austausch und der Verarbeitung von Informationen abhängig sind. Neurone und Kardiomyozyten bedienen sich elektrischer Prinzipien, die auf makroskopischer Ebene mit nichtinvasiven Verfahren wie Elektroenzephalografie (EEG) bzw. Elektrokardiografie (EKG) untersucht werden können. Für ein detailliertes Verständnis interzellulärer Kommunikation sowie zellulärer Reaktionen auf chemische oder physikalische Reize bieten sich jedoch In-vitro-Modelle an. Biosensoren auf Basis von Mikroelektroden-Arrays erlauben die Messung elektrischer Aktivität auf zellulärer Ebene und besitzen hohes Potenzial für eine Vielzahl von Anwendungen in der Grundlagenforschung und angewandten Forschung.

Biosensoren sind primär durch Methoden der Mikro- bzw. Nanotechnologie hergestellte Analysesysteme, in denen biologisch sensitive Elemente an Signalwandler gekoppelt werden, um analytische oder funktionale Informationen über physikalische und chemische Stimuli zu erhalten. Wird das biologisch sensitive Element durch isolierte Zellen oder Netzwerke von Zellen gebildet, ist eine Spezifizierung als zellbasierte Biosensoren angebracht, da diese neben der analytischen Klassifizierung eine insbesondere physiologische Beschreibung der Interaktion von Reiz und lebendem System erlauben. Durch Überführung zellulärer Reaktionen in qualitativ bzw. quantitativ verwertbare Signale sowie deren richtige Interpretation stellen zellbasierte Biosensoren eine bedeutende Ergänzung bzw. Alternative zu In-vivo-Studien dar.
Die Sprache der Nervenzellen
Werden elektrogene Zellen wie beispielsweise Neurone in vitro immobilisiert, stehen häufig elektrophysiologische Fragestellungen im Vordergrund, da die Mechanismen zellulärer Erregbarkeit für ein Verständnis von Pathogenese sowie für die Entwicklung und Validierung neuer therapeutischer Ansätze von besonderer Bedeutung sind. Elektrogene Zellen besitzen die Fähigkeit zur Ausbildung von Aktionspotenzialen. Diese charakteristischen, transienten Änderungen der Potenzialdifferenz über der Zellmembran können durch exzitat orische Stimuli provoziert und über synaptische Verbindungen auf nachgeschaltete Zellen übertragen werden. Eine Messung des Membran potenzials ist durch intrazelluläre Kon taktierung möglich. Hodgkin und Huxley untersuchten die zelluläre Erregungsbildung und -leitung mittels feiner Drahtelektroden, die in Axone des Tintenfisches inkorporiert waren und publizierten auf Basis der Ergebnisse ihr renommiertes mathe matisches Modell zur Beschreibung des Aktionspotenzials. Elektrophysiologische Untersuchungen auf Einzelkanalebene sind mit der im Jahr 1976 von Neher und Sakmann vorgestellten Patch-Clamp-Technik möglich. Hierbei wird die Zellmembran mit einer Glaskapillare kontaktiert und Ionen ströme im Pikoamperebereich werden messbar.
Symbiose von lebenden Zellen und elektronischen Schaltkreisen
Im Gegensatz zu konventionellen transmembranen Verfahren erlauben extrazelluläre Ableitungen mit Mikroelektroden- Arrays (MEAs, siehe Abb. 1) eine nichtinvasive und langzeitstabile Untersuchung elektrophysiologischer Eigenschaften von In-vitro-Systemen. Mit diesem Verfahren werden dissoziierte Zellen, reaggregierte zelluläre Netzwerke oder akute Gewebeschnitte, typischerweise von Ratten-, Mäusebzw. Hühnerembryonen, an planaren Mikro elektroden, die als Array in ein Glasoder Siliziumsubstrat eingebettet sind, immobilisiert. Je nach Chipkonfiguration befinden sich auf einer Fläche von wenigen Quadrat millimetern 60 oder mehr Mikroelektroden mit einem Durchmesser von 10 – 30 ?m. Durch die Kopplung elektrogener Zellen und Mikroelektroden lassen sich die durch Aktionspotenziale verursachten Ionenströme detektieren.
Neuronale Netzwerkformation in vitro
Werden dissoziierte Neurone auf dem Chip kultiviert, bilden diese innerhalb weniger Tage Neurite sowie synaptische Verbindungen und reetablieren auf diese Weise ein funktionales neuronales Netzwerk. Die Netzwerkformation wird durch die sukzessive Entwicklung neuronaler Aktivität begleitet, die durch die Implementierung mehrerer Mikroelektroden als Array auf dem Chip in hoher zeitlicher und räumlicher Auflösung analysiert werden kann. Nach etwa 3
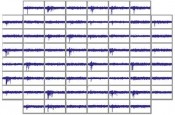 Wochen liegt ein scheinbar stochastisches Muster aus einzelnen Spikes (extrazellulär abgeleitetes Aktionspotenzial) und Bursts (hochfrequente Folgen von Spikes) vor. Die Amplituden der gemessenen Signale liegen im Bereich von etwa 102 – 103 ?V und sind wesentlich vom Zellmembran-Elektroden-Abstand abhängig (Abb. 2).
Wochen liegt ein scheinbar stochastisches Muster aus einzelnen Spikes (extrazellulär abgeleitetes Aktionspotenzial) und Bursts (hochfrequente Folgen von Spikes) vor. Die Amplituden der gemessenen Signale liegen im Bereich von etwa 102 – 103 ?V und sind wesentlich vom Zellmembran-Elektroden-Abstand abhängig (Abb. 2).
Epileptische Zustände auf dem Chip
Die Applikation neuroaktiver Substanzen führt zu spezifischen Änderungen im intrinsischen Signalmuster. GABA ist der wichtigste hemmende Neurotransmitter im Gehirn. Seine Rezeptoren sind Zielstruktur für eine Reihe von Arzneimittel, aber auch von Krampfgiften. Bicucullin beispielsweise ist ein kompetitiver GABA-Antagonist und konkurriert mit dem Neurotransmitter direkt um die Bindung am Rezeptor. Damit wird die inhibitorische Funktion von GABA blockiert, was eine Steigerung zellulärer Kommunikation erwarten lässt. In Experimenten mit MEAs kann dieser Effekt bestätigt werden. Die Zellen reagieren auf die Zugabe von Bicucullin mit einem dosis8.12 abhängigen Anstieg der Spikeund Burstereignisse sowie einer zunehmenden Synchronisierung der Netzwerkaktivität.
Kontraktionen unter dem Mikroskop
Kardiomyozyten bilden einen konfluentes Netzwerk auf dem Mikroelektroden-Array und zeigen ähnlich dem suffizienten Herzen rhythmisch auftretende Depolarisationen (Feldpotenziale), die zeitlich mit mechanischen Kontraktionen korrelieren. Je nach Präparation und Kulturdauer können bis zu 100 intrinsisch generierte Feldpotenziale pro Minute registriert werden. Der charakteristische Verlauf der Feldpotenziale kann durch selektive Blockierung von Ionenkanälen mit Arzneistoffen signifikant manipuliert werden. Kaliumkanalblocker der Gruppe Antiarrhythmika verzögern beispielsweise die Repolarisation und führen zu einer Verlängerung der Plateauphase. Aus der Provokation der In-vitro-Netzwerke mit dem Beta-Adrenozeptor- Agonisten Isoproterenol folgt hingegen eine dosisabhängige Steigerung der Kontraktionsfrequenz. Somit erlauben Mikroelektroden-Arrays eine experimentelle, funktionale Analyse der elektrophysiologischen Wirkmechanismen von pharmakologischen Substanzen. Den industriellen Anforderungen entsprechend könnten derartige Untersuchungen schließlich einen Beitrag zur Ermittlung pharmakologisch- toxikologischer Profile in der Arzneimittelentwicklung leisten.
„Goodbye, flat biology?“ (Nature)
In vitro kultivierte Zellen stellen weitgehend akzeptierte Modellsysteme in der angewandten Forschung und Grundlagenforschung dar. Konventionelle, zweidimensionale Netzwerke sind aufgrund ihrer Netzwerkarchitektur jedoch nur bedingt repräsentativ. Die zelluläre Kommunikation, Migration oder Morphologie ist nicht dreidimensional – wie im lebenden Organismus – angelegt. Dreidimensionale Modelle adressieren diesen Aspekt, um die physiologische Aussagekraft von In-vitro- Experimenten zu verbessern. Obwohl Methoden zur Kultivierung seit Jahrzehnten bekannt sind und 3D-Modelle erfolgreich beispielsweise für Anwendungen der Onkologie oder Entwicklungsbiologie (siehe Layer et al., Trends in Neurosciences) eingesetzt wurden, werden auf Mikroelektroden-Arrays dissoziierte Zellen primär als Monolayer immobilisiert. Sphärische Reaggregate, so genannte Sphäroide, stellen ein viel versprechendes 3D-Kultursystem für biosensorische Anwendungen dar. Diese etwa 300 ?m großen Netzwerke können durch Rotationskultur generiert werden und verzichten auf exogene Trägerstrukturen wie Collagen oder Matrigel. Sphäroide aus Neurone oder Kardiomyozyten können nichtinvasiv an MEA-Chips gekoppelt und mit konventionellen Strukturen von bis zu 20 Elektroden an unterschiedlichen Positionen des Netzwerkes abgeleitet werden. In den Experimenten zeigen Sphäroide hohe Langzeitstabilität. Während zweidimensional kultivierte Kardiomyozyten für maximal 10 Tage elektrische Aktivität erkennen lassen, sind bei Sphäroiden Kontraktionen über mehrere Wochen zu beobachten.
Fazit
Die Anwendungen zellbasierter Biosensoren sind vielfältig und befinden sich beispielsweise im Bereich der Pharmakologie, Toxikologie oder Grundlagenforschung. Die Entwicklung neuer Verfahren ist eine besondere und multidisziplinäre Heraus forderung, da neben wissenschaftlichen auch ökonomische und ethische Aspekte berücksichtigt werden müssen. Mikroelektroden Arrays erlauben die nichtinvasive Untersuchung elektrophysiologischer Phänomene von neuronalen Zellen und Kardio myozyten. Damit lassen sich zelluläre Reaktionen auf chemische oder physikalische Stimuli unter kontrollierten Labor bedingungen und reduzierter Netzwerkkomplexität analysieren. Mikroelektroden- Arrays sind hoch paralleli sierbar und erlauben eine kostengünstige und schnelle Analyse ganzer Substanzbibliotheken. Somit könnten Mikro elektroden- Arrays auch aus wirtschaftlichen Gesichtspunkten eine Ergänzung zu den ethisch bedenklichen Tierversuchen darstellen.
Literatur
Daus, A. W., Goldhammer, M., Layer, P. G., Thielemann, C. 2011, Electromagnetic exposure of scaffold-free three-dimensional cell culture systems. Bioelectromagnetics 32: 351 – 359. Daus, A. W., Layer, P. G., Thielemann, C. 2012. A spheroidbased biosensor for the label-free detection of drug-induced field potential alterations. Sensors and Actuators B 165: 53 – 58.
Bestel, R., Daus, A. W., Thielemann, C. 2012. A novel automated spike sorting algorithm with adaptable feature extraction. Journal of Neuroscience Methods 211: 168 – 178. Layer, P. G. et al., 2002, Of layers and spheres: the reaggregate approach
in tissue engineering. Trends in neurosciences 25: 131 – 134.
Foto: © Andreas Daus
|










