|
Wie wenig Immunsuppression darf/kann es zukünftig in der Nierentransplantation sein?
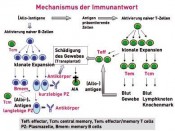
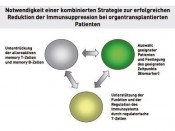
Wie wenig Immunsuppression darf/kann es zukünftig in der Nierentransplantation sein?In BalanceDie Pionierleistung der Nierentransplantation am Ende der 50er- Jahre des vergangenen Jahrhunderts ist nun zu einer „Routinemethode“ in der Behandlung chronisch niereninsuffizienter Patienten geworden. Dies ist neben vielen Faktoren auch der subtileren Kenntnis immunologischer Reaktionen des Transplantatempfängers auf die als „fremd“ oder besser „gefährlich“ erkannten Gewebemerkmale des Transplantates zu verdanken. Die Konsequenz dieses detaillierten Wissens um die komplexe Regulation von Immunantworten, deren fein abgestimmte Balance, die herausragende Bedeutung der spezifischen Immunantwort, vermittelt durch T- und B-Zellen, sowie das Verständnis, wie das immunologische Gedächtnis funktioniert, haben den Fortschritt in der Gestaltung der Immunsuppression beflügelt. Nun stehen wir vor der Frage, welche Kombination der Immunsuppression garantiert für eine möglichst große Patientengruppe mit einer sehr hohen Wahrscheinlichkeit den Transplantationserfolg? Und mehr noch: Welche Immunsuppressionskombination ist am Beginn der Transplantation effektiv genug, um die Balance zwischen den die Transplantatgewebemerkmale erkennenden sog. Effektor-T-Zellen und den sie „beruhigenden“ regulatorischen T-Zellen einzustellen und aufrechtzuerhalten, damit der Patient und dessen Transplantat im Langzeittransplantationsverlauf wenig klinische Auswirkungen der Medikamententoxizität erleben müssen. Das heißt u.a. eine Antwort auf die Fragen zu finden, wer was in welcher Kombination und wie lange braucht. Wir stehen also an der Schwelle neuer Strategien in der Gestaltung der Immunsuppression. Von welcher immunologischen und klinischen Ausgangssituation aus müssen diese Konzepte entwickelt werden? Ein kurzer (unvollständiger) Abriss eines komplexen Problems
In den letzten 20 Jahren ist eine Vielzahl von neuen – vor allem T-Zellen in ihrer Quantität und Funktionalität – regulierenden, immunsuppressiven Medikamenten („small molecules“, „biologicals“: poly- und monoklonale Antikörper, Fusionsproteine) in die Therapie eingeführt worden. Dies hat zu einer deutlichen Verbesserung des Transplantatüberlebens mit 1-Jahresfunktionsraten von 90 – 95 % geführt. Die effektivere Kombination verschiedener Medikamente, die unterschiedliche Pathways in der Regulation der spezifischen T-Zellantwort hemmen, hat im Wesentlichen eine deutliche Senkung der akuten Abstoßungsreaktionen bzw. deren Beherrschung in der Frühphase (gemeint sind die ersten Wochen/Monate) nach allogener Nierentransplantation erreichen können. Wir sind auch deutlich besser geworden, die vielfältigen, zum Teil auch lebensbedrohenden „Nebenwirkungen“ dieser Therapie zu beherrschen. Warum also neue Wege? Nun: 1. weil wir jetzt eine Reihe von diagnostischen Methoden in der Hand haben, die es erlauben, das „individuelle“ immunologische Profil eines Patienten besser (meint auch: reproduzierbar) beschreiben und verfolgen zu können, 2. weil wir aus klinischer und immunologischer Beobachtung lernen konnten, dass es Patienten gibt, die mit minimaler Immunsuppression hervorragende Langzeitverläufe erleben und weil wir aber als Transplant-Community 3. auf der anderen Seite realisieren mussten, dass unsere exzellenten 1-Jahrestransplantatfunktionsraten unsere immer niedriger werdenden und besser beherrschbaren Abstoßungsraten im „großen Maßstab“ zu keiner signifikanten Verbesserung der Langzeitergebnisse geführt haben. Wie sehen die Lösungsansätze aus, die gegenwärtig verfolgt werden? Strategie Nr. 1 Wir reduzieren sehr schnell oder vermeiden gänzlich vor allem die Medikamente, die mit einem hohen Nebenwirkungspotenzial vergesellschaftet sind – oder – ist wirklich alles notwendig?
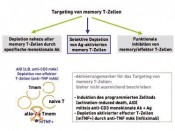
Hier sind im Wesentlichen 2 Substanzklassen zu nennen, wo es wünschenswert wäre, sie nicht einsetzten zu müssen oder die Gesamtdosis deutlich zu reduzieren: Das sind zum einen die Kortikosteroide (Prednisolon, Methylprednisolon) und zum anderen die so genannten CalcineurinInhibitoren (Cyclosporin A, Tacrolimus). Beginnen wir mit den Kortikosteroiden: Steroide haben ein so genanntes pleiotropes Wirkungsspektrum und hemmen sehr wirkungsvoll spezifische (durch T-und B- Zellen und deren freigesetzte Mediatoren vermittelte) und unspezifische (durch verschiedenste Zelltypen wie z.B. Monozyten, Makrophagen, dendritische Zellen, Eosinophile etc. und deren freigesetzte Mediatoren) Entzündungsreaktionen. Dies alles macht die Kortikosteroide nicht nur zu einem wirkungsvollen, sondern auch zu einem vielseitig einsetzbaren Immunsuppressivum. Die Nachteile dieses Medikaments liegen genau in seinen Vorteilen begründet – pleiotrope Wirkung bedeutet nämlich auch Hemmung von Immunzellen, die primär nicht gehemmt werden sollen, weil sie an dem spezifischen AlloantigenErkennungsprozess nicht vordergründig beteiligt sind und weil das Medikament bei Langzeittherapie auf viele Organsysteme „toxische“ Effekte vermittelt. Wenn man Kortikosteroide in der Therapie des Transplantatempfängers vermeidet u./o. sehr frühzeitig absetzt, dann resultieren als günstige Ergebnisse eine niedrigere Häufigkeit von Diabetes mellitus, kardiovaskulären Ereignissen (z.B. Herzinfarkt, Schlaganfall etc.) und grauem Star. Infektionsereignisse und Tumor häufigkeit werden nicht beeinflusst. Der Preis, den man zahlt, ist eine deutlich erhöhte Häufigkeit von Abstoßungsreaktionen und korrespondierend dazu eine schlechtere Nierentransplantatfunktion [1]. Wie sieht es mit dem Nutzen-Risiko-Profil bei der Vermeidung u./o dem zeitigen Absetzen von CalcineurinInhibitoren aus? Der Versuch vom Beginn der Transplantation an, diese Substanzklasse nicht therapeutisch einzusetzen [2] endete in einer unakzeptabel hohen Frequenz von Transplantatabstoßungen und einer 1Jahresfunktionsrate von ca. 65 %. Strategie Nr. 2 Wir nutzen am Beginn der Transplantation eine Kombination von verschiedenen Antikörpern, die die Weiche in Richtung stabiler Akzeptanz stellen – oder – man muss die naiven Immunzellen lehren, moderat zu reagieren! Um diesen therapeutischen Ansatz zu verstehen, ein Miniausflug in die Entwicklungslehre unseres immunologischen Gedächtnisses. Wir starten naiv und über unser Leben hinweg „speichern“ wir in Form von T/B-Gedächtniszellen gemachte „Erfahrung“ z.B. mit dem Erregerrepertoire unserer Umwelt, was uns befähigt, wie im richtigen Leben auch, eine erneute „Gefahrensituation“ ohne Umwege erkennen und hoch professionell bekämpfen zu können. Erworbene Erfahrung ist Segen und Fluch zu gleich, weil sie dazu befähigt, sich und seine Integrität zu schützen und weil sie aber häufig auch kreuzreagiert, insbesondere dann, wenn die Erkennungsmuster manchmal sehr ähnlich sind. Gedächtnis ist auch immer sehr individuell, was heißt, dass dieselben oder ähnliche Ereignisse je nach Umgebungssituation der Immunzellen, je nach Art der Präsentation von Gewebe- oder Zellstrukturen durch dafür wiederum spezialisierte Zellen (sog. Antigenpräsentierende Zellen) zu unterschiedlichen individuell regulierten Reaktionen führen. Gedächtniszellen zu unterdrücken, sie daran „hindern“, naive Immunzellen in die gleiche zerstörerische Richtung zu treiben, ist schwierig. Durch eine Antikörper- Kombinationstherapie, die frisch aktivierte Memory-Effektor-T-Zellen in den freiwilligen Zelltod treibt und die gleichzeitig ein Umgebungsmilieu schafft, das nachgebildete Immunzellen gegen die Transplantatgewebemerkmale „desensibilisiert“, konnten viel versprechende klinische Ergebnisse in einer „proof-of-concept“- Studie im Rahmen eines EU-Forschungsnetzwerkes (FP6 „RISET“) demonstriert werden. Mit diesem Therapiekonzept kann man offensichtlich mit einer Monotherapie eines niedrig dosierten Calciumantagonisten sehr gute Langzeitergebnisse für das Nierentransplantat erzielen. Diese Daten werden jetzt in einer großen klinischen multizentrischen Studie validiert [7]. Konzept 3 Wir regulieren die Balance in der Immunantwort über eine Zelltherapie – oder – Vorfahrt für regulatorische T-Zellen!
Immunantworten werden normalerweise über sehr verschiedene, zum Teil redundante Regelkreise in der Balance gehalten. In den letzten Jahren hat man die „Gegenspieler“ zu den Effektor-T-Zellen, die so genannten regulatorischen T-Zellen, genauer hinsichtlich ihres Phänotyps (Oberflächenmerkmale) und ihrer Funktionalität charakterisieren können. Diese regulatorischen T-Zellen haben die Aufgabe, starke oder überschießende Effektor-T-Zell- Antworten zu „beruhigen“ und somit letztlich auch Selbstzerstörung (autoimmune Reaktionen) zu verhindern. Die Biologie hat es nun so eingerichtet, dass die Effektor-T-Zellantwort sehr schnell etabliert wird und erst mit einer gewissen zeitlichen Verzögerung die regulatorischen Gegenspieler zum Zuge kommen. Im Rahmen einer Transplantatabstoßung lassen sich im Transplantat neben den zerstörerisch agierenden Effektor-T-Zellen auch regulatorische T-Zellen nachweisen, deren Effektivität allerdings zu gering ist, um den Abstoßungsprozess aufzuhalten. Dies ist u.a. auch der Tatsache geschuldet, dass die regulatorischen T-Zellen, die ohnehin quantitativ „unterlegen“ sind, sich unter dem Einfluss der Immunsuppression unzureichend vermehren können. Wir sind nun heute in der Lage, diese regulatorischen T-Zellen aus dem Blut von Patienten zu isolieren und über spezielle Techniken anreichern und vermehren zu können. Durch umfangreiche labor- und tierexperimentelle Daten wissen wir, dass diese regulatorischen T-Zellen effektiv sein können, ein Transplantat langfristig ohne dauerhafte Immunsuppression funktionstüchtig zu erhalten. Literatur
[1] Knigth, Simon; Morris, Peter (2010), Transplantation 89 (1): 1 – 14 Foto: © Prof. Dr. Petra Reinke |
L&M 3 / 2012
Das komplette Heft zum kostenlosen Download finden Sie hier: zum Download Der Autor:NewsSchnell und einfach die passende Trennsäule findenMit dem HPLC-Säulenkonfigurator unter www.analytics-shop.com können Sie stets die passende Säule für jedes Trennproblem finden. Dank innovativer Filtermöglichkeiten können Sie in Sekundenschnelle nach gewünschtem Durchmesser, Länge, Porengröße, Säulenbezeichnung u.v.m. selektieren. So erhalten Sie aus über 70.000 verschiedenen HPLC-Säulen das passende Ergebnis für Ihre Anwendung und können zwischen allen gängigen Herstellern wie Agilent, Waters, ThermoScientific, Merck, Sigma-Aldrich, Chiral, Macherey-Nagel u.v.a. wählen. Ergänzend stehen Ihnen die HPLC-Experten von Altmann Analytik beratend zur Seite – testen Sie jetzt den kostenlosen HPLC-Säulenkonfigurator!© Text und Bild: Altmann Analytik ZEISS stellt neue Stereomikroskope vorAufnahme, Dokumentation und Teilen von Ergebnissen mit ZEISS Stemi 305 und ZEISS Stemi 508ZEISS stellt zwei neue kompakte Greenough-Stereomikroskope für Ausbildung, Laborroutine und industrielle Inspektion vor: ZEISS Stemi 305 und ZEISS Stemi 508. Anwender sehen ihre Proben farbig, dreidimensional, kontrastreich sowie frei von Verzerrungen oder Farbsäumen. © Text und Bild: Carl Zeiss Microscopy GmbH |